- ホーム
- 2012:シグナル伝達の「ブレイクスルー・オブ・ザ・イヤー」
2012:シグナル伝達の「ブレイクスルー・オブ・ザ・イヤー」
2012: Signaling Breakthroughs of the Year

Sci. Signal., 1 January 2013
Vol. 6, Issue 256, p. eg1
[DOI: 10.1126/scisignal.2003881]
Michael B. Yaffe1,2* and Nancy R. Gough3
1 Chief Scientific Editor of Science Signaling, American Association for the Advancement of Science, 1200 New York Avenue NW, Washington, DC 20005, USA.
2 Professor, David H. Koch Institute for Integrative Cancer Research, The Broad Institute, and the Departments of Biology and Biological Engineering, Massachusetts Institute of Technology, Cambridge, MA 02139, USA.
3 Editor of Science Signaling, American Association for the Advancement of Science, 1200 New York Avenue NW, Washington, DC 20005, USA.
* Corresponding author. E-mail: myaffe@aaas.org
要約:Science Signalingは編集委員会のメンバーおよび編集スタッフの意見に基づき、2012年の最もホットなシグナル伝達研究にスポットライトを当てる。シグナル伝達と代謝の関係は依然として重要な分野である。がん、免疫学、発生生物学、神経科学および微生物学におけるシグナル伝達のブレイクスルーはいずれも候補に挙がった。シグナル伝達タンパク質およびネットワークの構造的および分子的洞察によって、がん治療における治療標的候補の特定だけでなく、合成生物学者と臨床医の連携も始まっている。
2012年はシグナル伝達分野における目覚ましい科学的進歩の年であった。今回は、他誌に発表された研究に加えて、Science Signalingに発表された特に重要な論文にも注目する。微生物シグナル伝達、がん関連シグナル伝達、神経可塑性を制御するシグナル伝達、および代謝と細胞シグナル伝達ネットワークの調節的関係の分野においてブレイクスルーや重要な進歩があった。
編集委員会の一部メンバーは、自らにとってのSignaling Breakthroughs of the Yearとなる研究成果も選出している。Solomon Snyder(ジョンズ・ホプキンス大学、米国)、Norbert Perrimon(ハーバード大学医学大学院、米国)はいずれも、シグナル伝達と代謝の関連を示した論文を選出した。SnyderはBruce Spiegelmanによるイリシンの発見を選出した(1)。イリシンは白色脂肪を褐色脂肪に「転換」して熱産生を高める能力から、筋肉の調節因子として知られるホルモンである。また、彼らは、がんにおけるワールブルク効果にとって重要な解糖酵素PKM2が、遺伝子転写に影響を及ぼすプロテインキナーゼでもあることを示した一組の論文も推薦している(2, 3)。
シグナル伝達アダプターも予想外の機能で話題になった。たとえば、Linらは、アダプタータンパク質のGrb2が受容体チロシンキナーゼである線維芽細胞増殖因子受容体の抑制因子として機能し、リガンドの非存在下で受容体の基礎活性を制限することを明らかに示した(Fig. 1)(4)。細菌のシグナル伝達では、偽キナーゼのMviNの構造解析と生化学的解析によって、このタンパク質がリン酸化され、細菌の細胞壁の合成を調節する足場として機能することが明らかになった(5)。また、免疫シグナル伝達において機能する腫瘍壊死因子(TNF)受容体会合因子(TRAF)ファミリーのアダプターの構造研究によって、足場特異性も明らかになった。Zhangらは、TRAF3とTRAF5が下流タンパク質と共役し、抗ウイルス応答を開始する能力の差に関与しているのはたった2つの残基であることを見いだした(6)。アダプター共役の特異性、およびアダプターがシグナル伝達経路活性をどのように調節するのかを理解することによって、高い特異性の薬物(この場合には抗ウイルス応答を損なわずに炎症を治療する薬物)の開発が可能になるかもしれない。
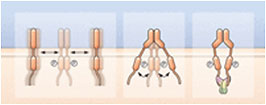
Fig. 1.
足場タンパク質のGrb2はFGFRの基礎活性を制限する。(左)受容体基礎活性化の膜上の拡散に基づくモデル。(中)リガンド非依存的な二量体の形成を介する受容体基礎活性。(右)リガンド非依存的に形成された二量体の活性のGrb2による抑制[許可を得て(20)から転載]。
CREDIT: Y. HAMMOND/SCIENCE SIGNALING
これまでの年と同様に、Gタンパク質共役受容体(GPCR)がBreakthroughsのリストに上った。今回は、転写調節因子であるyes会合タンパク質(YAP)の活性を抑制することによって細胞増殖を制限する、Hippo経路として知られる増殖調節経路の研究に関連するものであった。この経路の上流調節因子、およびHippoシグナル伝達経路の活性がどのように制御されているのかについてはほとんどわかっていない。Perrimonは、GPCRの下流にHippo経路を位置づけたKun-Liang Guanの研究室による研究を推薦した(7)。「本研究の以前には、(Hippoシグナル伝達の)上流の調節におけるいくつかの受容体(FatおよびCrumbs)の役割が示唆されていたが、それらが下流の成分をどのように調節しているのかは不明である。この分野では、GPCRシグナル伝達状況下でのこれらの受容体の機能を明らかにすることが必要である」(Fig. 2)。
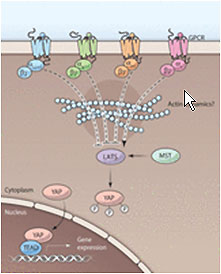
Fig. 2.
GPCRを介するHippoシグナル伝達の調節[(7)から転載]
CREDIT: Y. HAMMOND/SCIENCE SIGNALING
シグナル伝達経路、および細胞の順応と応答は、経路内のタンパク質によってだけでなく、これらのタンパク質の翻訳後修飾やRNAによるその存在量や活性の調節によっても影響も受ける。Greenberg、Wolberger、Matunisらの研究(8)は、ユビキチンおよび低分子ユビキチン様修飾因子(SUMO)による修飾サイクルがいかに入り組んで複雑であるのかを示した。彼らは、ユビキチンとSUMOを含むハイブリッド鎖を同定した。このハイブリッド鎖は、E3リガーゼのRNF4によって生成され、DNA二本鎖切断部位に修復タンパク質を局在化させるために、アダプタータンパク質のRAP80によって特異的に認識される。彼らの報告は、リン酸化、ユビキチン化およびSUMO化をDNA損傷の修復に結び付ける統合機構を示している。RNAによる調節に関しては、J. David Sweatt(アラバマ大学バーミンガム校、米国)が、長期的なシナプス可塑性のエピジェネティック調節因子としての神経細胞piwi-interacting RNA(piRNA)のEric Kandelによる発見を推薦した(9)。このように、シグナル伝達ネットワークにおける複雑性は、DNA、RNAおよびタンパク質レベルでの調節の階層によって間違いなく拡大する一方であろう。
最後に、PerrimonとYaffeはともに、がんに対するシグナル伝達の治療上の意義の発展が今年の選出に値すると考えた。Jeffrey Settlemanの研究では、がん細胞がいわゆる「中毒になっている」受容体を標的とすることによって治療されてきたがんにおける治療抵抗性の発現の根底に、受容体チロシンキナーゼ下流のシグナル伝達の重複性がどのように関与するのかについて検討した(10)。関連する研究は、Jeffrey Engelmanの研究室およびRené Bernardsの研究室でもなされた(11, 12)。Gary Johnsonの研究室でもキナーゼ阻害薬単剤療法によるカイノームの「再配線」に関して同様の知見が得られており(13)、マイトジェン活性化プロテインキナーゼ(MAPK)経路の構成要素であるRafの阻害薬およびMAPKキナーゼ(MEK)の阻害薬の併用は、トリプルネガティブ乳がん細胞の死滅に関して相加的ではなく、相乗的に機能するという直観と反する発見を合理的に説明した。受容体チロシンキナーゼ阻害薬によるがん治療における別の治療上重要な知見として、Ganes Senの研究室は、上皮増殖因子受容体(EGFR)を阻害すると、Toll様受容体シグナル伝達およびこれら2つの受容体間のクロストークを介する抗ウイルス応答が損なわれる可能性について報告した(14)。実際に、この研究がきっかけとなって、Burtnessらは、Letterで、EGFRシグナル伝達および哺乳類ラパマイシン標的タンパク質(mTOR)シグナル伝達を遮断するがん治療では、患者の感染リスクが許容できないほど高くなる可能性があり、いくつかの臨床治試が中止に至っていることについて述べた(15)。
2012年は多くの意味で、合成生物学、シグナル伝達、および免疫学が、がん治療の臨床分野に進出した年であった。われわれの同僚であるSung-Yun Pai(ボストン小児病院、米国)は、操作した腫瘍特異的T細胞を用いた養子免疫療法が臨床上効果的な抗がん戦略となりつつあると述べている。細胞外部分が腫瘍特異的マーカーまたは腫瘍標的サイトカインに対する単鎖抗体であり、かつ細胞内部分がCD3z単独またはT細胞共刺激分子との組み合わせのシグナル伝達ドメインであるハイブリッドキメラ抗原受容体に腫瘍細胞が会合すると、T細胞依存性免疫殺滅を活性化する(Fig. 3)。2012年のブレイクスルーは、白血病患者の臨床治験および患者由来グリオーマ細胞株で示されたこの戦略の有効性である(16-19)。シグナル伝達経路を操作して天然に存在しないハイブリッド分子を創出することによって細胞応答を「配線し直す」というこのタイプの合成生物学的アプローチは、多様な疾患に対する次世代治療薬に関する示唆に富んでいる。
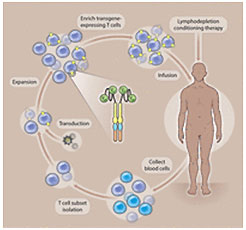
Fig. 3.
キメラ抗原受容体療法。操作したT細胞受容体は、腫瘍関連抗原を認識する重鎖および軽鎖の可変領域(VHおよびVL)(緑)、T細胞受容体の共受容体であるCD8からの膜貫通ドメイン(黄)、そして2つの異なる共刺激受容体に由来する2つの細胞質シグナル伝達ドメイン(青および橙)を有する単一断片長の抗体を有する[(21)から転載]。
CREDIT: Y. HAMMOND/SCIENCE SIGNALING
われわれの選んだ最もエキサイティングな研究について詳述するが、他の注目すべき分野も次々と脚光を浴びている。このような分野としては、特異的な翻訳後修飾がどのようにしてシグナル伝達経路ネットワークを調節し得るのかに関するシステム生物学、およびキナーゼシグナル伝達経路、プロテアーゼシグナル伝達経路および脂質シグナル伝達経路のクロストークの複雑性などに関するシステム生物学で得られた知見が挙げられる。
では今年のシグナル伝達のブレイクスルーとなるのは何であろうか。水晶玉はまだくもっている。しかし、シグナル伝達とますます広がる全ゲノム配列決定の取組みを結び付けるシステムおよび計算に基づく洞察が選ばれることは間違いない。まだ「Breakthrough of the Year」のレベルには達していないものの、2012年の主要な発見となった(そして2013年にはさらに飛躍が見込める)その他の重要な知見としては、レドックスシグナル伝達の新たな役割、シグナル伝達による代謝の調節とその逆、つまり代謝によるシグナル伝達ネットワークの調節、インフラマソームの制御と機能、マイクロRNAによる調節およびマイクロRNAの調節、そしてリボソームに対するシグナル伝達の影響などが挙げられ、これらはいずれも2013年のブレイクスルーの候補である。本誌読者は間違いなく、ブレイクスルーを目の当たりにする特等席にいる。
Citation: M. B. Yaffe, N. R. Gough, 2012: Signaling Breakthroughs of the Year. Sci. Signal. 6, eg1 (2013).
2013年1月1日号