- ホーム
- 2008:シグナル伝達の「ブレークスルー・オブ・ザ・イヤー」
2008:シグナル伝達の「ブレークスルー・オブ・ザ・イヤー」
2008:Signaling Breakthroughs of the Year

Sci. Signal., 6 January 2009
Vol. 2, Issue 52, p. eg1
[DOI: 10.1126/scisignal.252eg1]
Elizabeth M. Adler*
Associate Editor of Science Signaling, American Association for the Advancement of Science, 1200 New York Avenue, N.W., Washington, DC 20005, USA.要約 : 本年にシグナル伝達の分野で得られたブレークスルーは、タンパク質結晶から細胞まで、また細胞内の構造から全ゲノムに至るまで多岐にわたっていた。候補となった研究は、脳およびB細胞中のシナプス、シグナル伝達ネットワークの進化と調節、新しいクラスの植物ホルモンの同定、がんや統合失調症などの疾患の原因と治療に関する知見、運動をしないで体型を保つ方法などであった。
2008年は本誌Science Signalingにとって、まさにエキサイティングな1年であった。新たな雑誌名の誕生、冊子版の発行、そして中でも刺激的だったのは、雑誌に一次調査論文を取り入れたことである。長期愛読者の皆さんにも、新たに読み始められた方々にも、すべての読者の皆様にこの新たな特徴と、従来から親しまれてきた長年の特徴とを楽しんで頂けることを、我々は心から願っている。2009年を私たちの最新のKnowledge Environmentとともに迎えられたこと、そしてお馴染みのEditorial Guideであるシグナリング・ブレークスルー・オブ・ザ・イヤーで幕開けできることを嬉しく思っている。この年1回の特別号では、Science Signaling編集部委員と他の著名な細胞シグナル伝達の研究者に対して、シグナル伝達研究の分野で最も興味深い進歩は何であったのかを推薦してもらっている。2008年シグナリング・ブレークスルー・オブ・ザ・イヤーの候補を挙げて下さったすべての科学者の皆様に感謝申し上げ、本年の最終候補をここに掲載させて頂く。候補を挙げて下さった方は、以下のとおりである。Joanne Chory(米国、ソーク研究所)、David Fruman(USA米国、カリフォルニア大学)、Tony Hunter(USA米国、ソーク研究所)、御子柴克彦(理化学研究所、脳科学総合研究センター)、Randall Moon(米国、ワシントン大学)、Norbert Perrimon(Harvard Medical School、USA米国、ハーバード大学医学部)およびSolomon Snyder(Johns Hopkins University、USA米国、ジョンズホプキンス大学)。2008年にシグナル伝達の分野で得られたブレークスルーは、タンパク質結晶から細胞まで、また細胞内の構造から全ゲノムに至るまで多岐にわたり、生物界全体に広がった。候補となった研究は、脳およびB細胞中のシナプス、シグナル伝達のネットワークの進化と調節、新しいクラスの植物ホルモンの同定、がんや統合失調症などの疾患の原因と治療に関する知見、運動をしないで体型を保つ新たな方法に関するものであった。
今年の候補となったテーマの中には、シグナル伝達ネットワークの理解と解析のためのアプローチと、包括的データセットの細胞シグナル伝達解析への応用があった。Norbert Perrimonは、多様な分子データを用いて酵母の調節ネットワークを再構築したZhuらの論文に、我々の目を向けさせてくれた(1)。Zhuらは、遺伝子型データ、転写因子結合部位データおよびタンパク質間の相互作用データを組み合わせたベイジアン・ネットワークが最も予測能が高いこと、そして遺伝子発現の「ホットスポット」の調節因子を同定するために用いることができることを見出した(1)。このような種類の解析を行うことができるかどうかは、包括的なデータセットが利用可能かどうかに依存し、現時点では、酵母はそのようなアプローチが今のところ可能な数少ないモデル系の1つである。ただし、何らかのゲノムワイドの分子的データの利用は、本年の他数件の候補研究でも大きく取り上げられていた。Perrimonが2つ目に挙げた候補研究は、Miliらによるものである。すなわち、移動しつつある線維芽細胞を偽足と細胞体に分け、これら2つの画分をゲノムワイドスケールのRNAスクリーニングにかけたとき、偽足画分には50を超えるmRNAが濃縮されることを確認し、これらの偽足内mRNAの固定における家族性大腸腺腫症(APC)遺伝子というがん抑制因子の予想外の役割を発見した(2)。Randall Moonは、ヒト細胞に対してゲノムワイドの短鎖ヘアピンRNAまたは低分子干渉RNA(shRNA/siRNA)による機能喪失スクリーニングを応用し、さらにこれをプロテオーム解析と組み合わせた研究(3, 4)を候補として挙げ、「短時間だけ1つの経路に関与するあらゆる遺伝子探し出すことは遺伝学では容易ではないので、これは1つの前進といえる」と述べている。実際に、Harlowと共同研究者の発表した一連の論文は、細胞間のシグナル伝達経路は予想以上に多様であることを示唆している(5-8)。したがって、Moonが指摘したように、多種のヒト細胞にshRNAまたはsiRNAによるゲノムワイドのノックダウンを応用する手法によって、細胞株同士の間でのシグナル伝達経路の本質的な違いが明らかになり、薬物と治療法の発見が促される可能性がある。
ネットワークをテーマとする最後の一群の候補研究は、細胞シグナル伝達ネットワークの進化を解明したものである。生物学的な調節ネットワークの本質、およびシグナル伝達ネットワークで見られる複雑で頑健な機構がどのように進化したのかを見事に実証するなかで(9, 10)、Isalanらは、ある一つの遺伝子の調節プロモーターの配列を、別の遺伝子のオープンリーディングフレームとつなぎかえることになる重複イベントの影響を、細菌において解明した。そして最後に、Tony Hunterは、進化系統樹(図1)中の後生動物の枝の基部近くの単細胞生物において、複雑なチロシンリン酸化のネットワークの存在を発見し、ホスホチロシンによるシグナル伝達の進化について非常に興味深い知見を与えた一連の論文を候補とした(11-13)。これらのを推す際に、Hunterは次のようなコメントを添えている。「長年、チロシンキナーゼとホスホチロシンを基盤とするシグナル伝達の起源に関して多くの推測がなされてきた。さらに、チロシンリン酸化を基盤とするシグナル伝達は細胞間のコミュニケーションにとって重要であるので、チロシンリン酸化のネットワークは多細胞生物の進化とともに獲得され、おそらくは多細胞生物の生活様式の獲得に必要なものだったとも提唱されていた。したがって、配列決定が最近完了した襟鞭毛虫Monosiga brevicollisにおけるチロシンリン酸化に関与するタンパク質を分析した2つの論文(Manningら、Pincusら)で、きわめて多様なチロシンキナーゼ、チロシンホスファターゼ(PTP)、SH2とPTBドメインなどの存在が報告されたことは大きな驚きであった。Srcファミリーキナーゼと一部のSH2およびPTPドメイン以外には後生動物にオルソロガスなものはなく、このことは襟鞭毛虫が、単純なチロシンリン酸化系を有する襟鞭毛虫と後生動物のもととなった共通の祖先から、ホスホチロシンによるシグナル伝達ネットワークを独自に発達させたことを示唆している。」
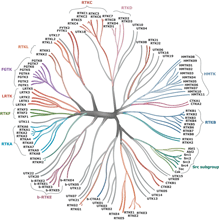 View larger version (57K): |
図1 |
Solomon Snyderがその後輩であるJeffrey Ehmsen、Bindu PaulおよびMichael Koldobskiyと共に推薦している候補論文の3報のうち最初の1報で、Solomon Snyderは、シグナル伝達の関心対象を、一つの群のキナーゼを介するシグナル伝達の進化から、これまで未知であったキナーゼクラスで最初に発見されたメンバーの同定へと移している(図2)(14, 15)。その推薦文の中でSnyderは次のように説明している。「キナーゼ酵素によるタンパク質のリン酸化は、生物学的情報伝達の中心である。しかし、キナーゼのうちでおよそ10分の1はリン酸化を媒介する配列を欠いており、そのために偽キナーゼと呼ばれる。Thomas SudhofとMarkus Wahlの研究室は、そのような偽キナーゼの1つと推定されるCASKが実際にキナーゼ活性を持っていながら、古典的なキナーゼ酵素とは異なり、キナーゼ活性にとって一般に重要であると考えられているマグネシウムとは結合しないことを明らかにした。シナプスタンパク質のニューレキシン-1をリン酸化するCASKは、まったく新しいクラスのタンパク質キナーゼを予感させるようである。」
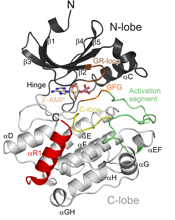 View larger version (41K): |
図2 |
Gタンパク質共役型受容体(GPCR)は、もちろんシグナル伝達タンパク質の最大のファミリーの1つである。脳内に存在するGPCRは、様々な神経伝達物質に対する受容体として働いている。Snyderは2つめの候補(16, 17)を挙げる中で、次のように述べている。「これまでの薬理学的データから、特定の抗精神病薬の作用には、セロトニン受容体とグルタミン酸受容体の両方が関わっているとされてきた。Stewart Sealfonの研究室からGonzalez-Maesoらによって発表された論文では、セロトニンとグルタミン酸に対する新たなGPCR複合体が、抗精神病薬の作用や統合失調症の病態生理にも関わっていると報告されている。クロザピンやオランザピン(商品名ジブレキサ)などの主要な「新世代」の抗精神病薬の中には、少なくとも一部はセロトニン受容体のサブタイプ5HT2Aを遮断することによって作用するものがある。さらにグルタミン酸受容体mGluR2は、統合失調症に対する有効な新薬により刺激される。Sealfonの論文はこれら2種類の受容体が互いに結合し、一方の活性化が他方の機能に影響することを明らかにしている」。さらにSnyderが指摘したように、未治療の統合失調症患者の脳組織では5HT2A受容体の存在量が増大し、mGluR2の存在量が減少していることが示され、このことは、抗精神病薬の作用と受容体の発現の調節不全との間に整合性があることを示唆する。御子柴克彦もGPCRにも注目し、オプシンの結晶構造について述べた同じ研究グループからの2報を候補として挙げている(18, 19)。これらの論文は、GPCRが活性化される機構の解明に役立ち、GPCRの機能を修飾できる薬物の開発をもたらすものであった。
次の候補として、Snyderと御子柴はいずれもシナプス(1つの神経が下流の神経に情報を伝える特殊な構造)でのシグナル伝達を調節する過程に目を向けた。シナプス機能の長期増強(LTP)は、学習と記憶に関連する使用頻度に応じたシナプス効率の増大であり、シナプス後膜でのカルシウム流入によって生じる。これが低分子量グアノシン三リン酸(GTPase)Rasの活性化など、シグナル伝達イベントの鎖の引き金となる。Snyderは、最後の候補研究として、ラットの海馬ニューロンでは、カルシウムではなくRasの活性化が近隣の樹状突起棘に広がり、隣接するシナプスで機能的に共役するLTPを誘導する(図3)ことを示したSvobodaの研究室からの論文(20)を挙げている。御子柴は、シナプス抑制からの回復には、脱感作したAMPA型グルタミン酸受容体の新たに合成された受容体による急速な交換が関係することを示したHeineらの論文を候補としている。さらに御子柴は、胚性幹細胞がどのようにして様々な種類の機能性皮質神経に誘導されるかを示した永楽らによる研究を推薦した。この研究は、移植によって神経機能を回復させる臨床的アプローチを示した点で重要な意味をもつと思われる(23)。
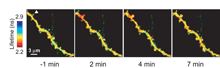 View larger version (21K): |
図3. |
ギリシア語の「共に繋ぐこと」に由来する「シナプス」という言葉は、かつてはニューロン間、またはニューロンと標的筋肉あるいは腺細胞との間の接合部のみを意味していたが、ごく最近になって、リンパ球と膜結合抗原を提示する細胞との間の接合部にも使われるようになった。T細胞の免疫学的シナプスが大々的に研究されていることを指摘しながら、David Frumanは「立て続けに発表された論文:Facundo Batistaとその共同研究者らは、B細胞のシナプス形成と下流のシグナル伝達に関する多くの重要な事柄の詳細を調べあげた(24-27)」を推薦した。B細胞の活性化は、B細胞受容体(BCR)複合体への抗原の結合によって開始される。BCR共受容体複合体の一部として、共受容体CD19がCD21(2型相補的受容体としても知られる)とともに最も一般的に機能している。CD19またはCD21のどちらかを欠損するマウスは免疫不全を呈するが、CD19欠損マウスの免疫不全の方がより重篤であった。推薦文の中でFrumanは次のように記している。「特に予想に反した結果は、CD19分子の一部がBCRのマイクロクラスターと会合し、CD19/CD21共受容体複合体のリガンドがない状態において、抗原依存性のB細胞マイクロクラスター形成を促進する(25)。このことが、CD21ノックアウトマウスに比べてCD19ノックアウトマウスの方が、より重篤なB細胞免疫不全になることの理由であると思われる。」
Frumanは、2番目の候補として、がん治療に対する細胞シグナル伝達研究の応用に注目した。プロテインチロシンキナーゼとホスホイノシチドキナーゼが関わるシグナル伝達の異常は、がんの発症に関係するとされてきた。実際に、ホスファチジルイノシトール-3-OHキナーゼ(PI3K)によるシグナル伝達は、チロシンキナーゼ阻害剤に対する数種のがんの耐性にかかわる機構として浮上し、さらに両ファミリーのキナーゼは、創薬の標的として盛んに研究されている。Frumanが候補とした研究は、プロテインチロシンキナーゼとホスホイノシチドキナーゼの両方に対する小分子阻害剤を同定することによって、この問題に正面から取り組んだものであった(28)。Frumanは次のように述べている。「分子標的治療の分野は、一般に意図した標的に対して極めて敏感な化合物の開発を目的としてきた。しかし、耐性や予想外のフィードバック経路の出現によって、多くのがん細胞の生存を抑えるためには、複数のシグナル伝達が収斂する点を標的とする必要性が強調されてきた。ランダムスクリーニングによって、多数の「二重」阻害剤が同定されている。この論文では、薬学的に扱いやすい2つのクラスのキナーゼ標的を阻害する化合物の合理的設計のための化学的原理を規定している。」キナーゼは細胞代謝の制御にも関わっており、腫瘍細胞ではその代謝が変化し、酸素が豊富に存在していても酸化的リン酸化に移行するのではなく、(嫌気的解糖の場合のように)乳酸が生成されることが古くから知られている。このような代謝異常(ワールブルク効果と呼ばれる)と腫瘍形成との正確な関係は不明である。Perrimonが候補としたChristofkらの論文は、ピルビン酸キナーゼのM2型アイソフォームがワールブルク効果に重要で、腫瘍形成にも関係していることを確認したものである(29)。
TOR(target of rapamycin:ラパマイシン標的)キナーゼは、細胞の栄養とエネルギー状態に関わるシグナルを増殖因子からのシグナルに統合し、細胞の成長と増殖の調節に重要な役割を果たす。TORはラパマイシンによって阻害される。ラパマイシンは臨床的に免疫抑制剤として、またがん治療にも用いられる抗真菌薬である。一部のがんで調節障害が生じているTORシグナル伝達は、一時期精力的に研究されていた。実際に、TORシグナル伝達の進歩は、2003年のシグナル伝達ブレークスルーに取り上げられた。しかし、昨年中に得られた特にエキサイティングないくつかの知見から、Frumanは、2008年のブレークスルーの1つとしてmTOR(哺乳動物のTOR)の機構と機能における進歩を候補に挙げるべきであると確信するに至った。Frumanは、最も際立った最近の発見は、アミノ酸からmTOR complex-1(mTORC1)へのシグナル伝達のメディエーターとしてRagファミリーのGTPaseが同定されたこと(30, 31)、mTOR complex-2(mTORC2)の新たな基質が同定されたこと(32-34)、さらにラパマイシンが免疫機能に作用する新たなメカニズムが同定されたことであると述べた。後者について述べるにあたり、Frumanは「これらの論文のうちの2つで、ラパマイシンが、Toll様受容体のリガンドによる自然免疫細胞(マクロファージ、単球、樹状細胞)からのサイトカイン分泌パターンを変化させることが明らかとなった(35, 36)。臨床的に承認されている免疫抑制剤であるラパマイシンは、以前には主にリンパ球増殖の抑制によって機能していると考えられていた。しかし新たに行われたこれらの研究から、自然免疫に対するラパマイシンの免疫調節作用が浮き彫りにされた。もう1つの論文は、T細胞に対するラパマイシンの作用は細胞周期停止だけではないこと、具体的には、T細胞の活性化を伴うホーミング/トラフィッキング受容体の変化をラパマイシンが遮断することを明らかにした(37)。」TORと同様に細胞のエネルギー状態をモニターしているアデノシン一リン酸(AMP)活性化プロテインキナーゼ(AMPK)は、Perrimon(38)が推薦した興味深い研究で大きく取り上げられている。この研究で、AMPKアゴニストが4週間投与された運動性の低いマウスでは持久力が向上していること、また酸化代謝に関連する筋細胞遺伝子の発現が増大しており、それが運動を模倣するものとして働いていることが明らかにされた。ただし、AMPKの活性化が運動のもつ他の有益な効果をもたらすのかについては依然として不明である。
細菌、原生生物、菌類および哺乳動物におけるシグナル伝達のブレークスルーを考えてきた我々は、2008年ブレークスルーの最後を飾る発見により植物界に目を向けることになる。すなわち、新たなクラスのホルモン「ストリゴラクトン」の同定は、深く感動的な進展をもたらした。Gomez-RoldanらとUmeharaらはそれぞれの論文で同時期に、植物根に共生する真菌に対してシグナルを送ることが知られていたカロテノイド由来化合物であるストリゴラクトンを、亜頂端の芽からの枝分かれを抑制するホルモンとして同定した(図4)(39-41)。この研究を候補として挙げる中で、Joanne Choryは次のようにコメントしている。「植物ホルモンは長年、オーキシン、サイトカイニン、エチレン、アブシジン酸およびジベレリンの5クラスのみとされてきた。1990年代中ごろにブラシノステロイドが、さらにその数年後にはジャスモン酸が加えられた。遺伝学的解析からはさらに別の植物ホルモンが存在するに違いないと予想されてはいたが、ストリゴラクトンが植物の側枝形成を抑制する移動性のシグナルであることを示す大量の証拠が得られるまでには、ほぼ10年の歳月を必要とした。2つの研究室がようやく、植物の側枝形成を抑制する移動性シグナルがストリゴラクトンであるという説得力のある主張を確立したのである。これらをまとめると、ストリゴラクトンが植物で合成され、芽に運ばれ、枝分かれの作用に対抗することは疑うまでもない。」
 View larger version (82K): |
図4. |
ここに選んだ素晴らしい革新的研究の数々を喜んでいただけただろうか。今後もScience Signalingをお楽しみいただき、生物界全体に広がるシグナル伝達のエキサイティングな発展を見守っていただければ幸いである。
E. M. Adler, 2008: Signaling Breakthroughs of the Year. Sci. Signal. 2, eg1 (2009).






