- ホーム
- 2011:シグナル伝達の「ブレイクスルー・オブ・ザ・イヤー」
2011:シグナル伝達の「ブレイクスルー・オブ・ザ・イヤー」
2011: Signaling Breakthroughs of the Year

Sci. Signal., 3 January 2012
Vol. 5, Issue 205, p. eg1
[DOI: 10.1126/scisignal.2002787]
Elizabeth M. Adler*
Senior Editor of Science Signaling, American Association for the Advancement of Science, 1200 New York Avenue, N.W., Washington, DC 20005, USA.
*Contact information. E-mail: eadler@aaas.org
要約: Science Signaling編集委員一同、2012年の幕開けを記念すべきシグナル伝達の「ブレイクスルー・オブ・ザ・イヤー」の第10回を迎えることができたことを嬉しく思う。前年に発表された最もエキサイティングな細胞シグナル伝達研究をまとめたシグナル伝達のブレイクスルーのリストは、細胞シグナル伝達に大きな進歩をもたらした研究、特に予想を覆すような研究や新たな道を切り開いた研究としてScience Signaling編集委員が推薦した論文から選出されている。今回掲載されたのは、シグナル伝達タンパク質の構造解析、イメージングの技術的進歩、および遺伝子発現、免疫機能、細胞ストレス応答の制御機構に関する洞察などについてブレイクスルーである。
シグナル伝達の「ブレイクスルー・オブ・ザ・イヤー」の第10回年報には、作用中のβアドレナリン作動性受容体の描写、遺伝子発現の調節における意外な発見、免疫機能に関する新たな洞察、細胞のストレス感知および応答の機構の理解における興味深い進展、神経科学およびカルシウムイメージングにおけるエキサイティングな技術的進歩などが掲載されている。本年度のシグナル伝達のブレイクスルーを推薦いただき、かつ選出の過程にも携わっていただいた次の科学者の皆さまのすべてに謝意を表します:K. Mark Ansel(University of California, San Francisco)、Ivan Dikic(Goethe University Medical School, Germany)、Henrik Dohlman(University of North Carolina Chapel Hill, USA)、David Fruman(University of California, USA)、Toby Gibson(European Molecular Biology Laboratory, Germany)、Donald L. Gill(Temple University School of Medicine, USA)、Katsuhiko Mikoshiba(RIKEN Brain Science Institute, Japan)、Solomon Snyder(Johns Hopkins University, USA)、Eric Vivier(Centre d'Immunologie de Marseille-Luminy, France)。
Gタンパク質共役受容体(GPCR、7回膜貫通型受容体とも呼ばれる)は、ホルモンや神経伝達物質に対する多くの細胞応答を伝達し、視覚、嗅覚および味覚を媒介する膜受容体の大きなファミリーを構成する。さらに、GPCRは臨床的に重要な多数の薬物の標的となっている。GPCRは、その生理学的役割や薬理特性に基づいて特定され、一連の技術的進歩(放射性リガンド結合から精製および再構成、クローニングおよび構造解析に至るまで)を介して集中的に研究されており、最も研究の進んだシグナル伝達タンパク質群である。β2アドレナリン作動性受容体は約40年間にわたってGPCRシグナル伝達モデルとして用いられてきた。この研究によって、ヘテロ三量体グアニンヌクレオチド結合タンパク質(Gタンパク質)のヌクレオチド結合αサブユニット(Gα)でGDPからGTPへの交換が起こり、ヘテロ三量体がGα-GTPおよびβγサブユニットに解離し、下流エフェクターとの相互作用を可能にするという、GPCRによるGタンパク質の活性化の古典的パラダイムが例示された。しかし、アゴニストが結合したGPCRが、アゴニスト、受容体およびGタンパク質からなる三者複合体において、対応するGタンパク質を活性化する構造的基盤は不明であった。DohlmanおよびMikoshibaは、いずれもBrian Kobilkaらによる研究を推薦した。この研究では、X線結晶解析と電子顕微鏡法を組み合わせて用いて、Gs(アデニル酸シクラーゼを活性化するGタンパク質)に結合するβ2アドレナリン作動性受容体を可視化し(図1)、GPCRシグナル伝達に関する未だかつてない像を提供した(1-3)。Dohlmanが述べたように、「この十分に予想された構造は、史上初の膜貫通シグナル伝達複合体のスナップショットである。重要なことに、これはヌクレオチド非結合型のGタンパク質であり、受容体による活性化の最中の、いわば「現行犯逮捕」であった。また、本研究は、世界中の共同研究者から成る混成チームによる20年間に及ぶ努力の結晶であり、忍耐と協力の力を立証するものでもある。」
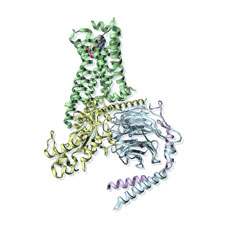
図1
Gsと結合したβ2アドレナリン作動性受容体の構造。β2アドレナリン作動性受容体:緑、リガンド:赤、青および灰色、Gα:金色、Gβ:水色、Gγ:紫
CREDIT: Y. HAMMOND/SCIENCE SIGNALING
Toby Gibsonも構造解析によって細胞シグナル伝達に新たな洞察を与えた研究を推薦した。ただしこの場合には、アクチン重合状態の変化がどのようにして遺伝子発現の変化へと翻訳されるのかを示したMouilleronらの研究であった(4)。アクチンは、細胞内で単量体(Gアクチン)と高分子フィラメント(Fアクチン)の平衡状態として存在している。その結果として、アクチン重合を促進し、それによって細胞の形状および運動性の変化を促進するシグナルは、Gアクチン濃度を低下させることになる。転写コアクチベーターのMRTF-A(ミオカルジン関連転写因子A)はGアクチン単量体と結合する。Mouilleronらは、GアクチンとMRTF-Aアクチン結合領域の間の複合体の結晶構造解析によって、Gアクチン濃度の上昇がどのようにしてMRTF-Aの細胞質への隔離を促進し、それによって標的遺伝子の活性化を防ぐのかを決定することができた。
本年度のシグナル伝達のブレイクスルーに推薦された遺伝子発現調節に関する興味深い意外な発見は、アクチンを介する転写調節の基盤の構造的洞察だけにとどまらない。Fruman、Gibson、AnselおよびSnyderは、全員がこの分野の研究を推薦した。この分野のブレイクスルーには、真核生物および細菌における遺伝子調節、および疾患および発生における遺伝子調節に関するものが含まれていた。推薦された研究は、アセチル化ヒストンと結合して、クロマチン構造を修飾し、それによって転写を促進するブロモドメイン含有タンパク質を標的とする治療戦略から、新規と思われる転写様式にまでわたった。
MYCはヒトのがんにおける最も有名ながん遺伝子の一つであるが、残念なことに、Mycは古典的な「新薬開発につながる」標的ではないことに注目し、Frumanは、Myc機能の別の阻害様式を特定したDawsonら(5)、Delmoreら(6)、Mertzら(7)およびZuberら(8)の研究を推薦した。「本年に発表された4つの論文は、Myc発現を抑制する小分子化合物を特定することによって大きなブレイクスルーとなった(5-8)。これらの化合物は、MYCおよび他のがん関連遺伝子のプロモーター上で、BETブロモドメイン含有タンパク質の転写複合体への結合を阻害する。2つの異なるBET阻害剤が、血液がんモデルにおいて有効性を示した。これらの知見は、がん治療に大きな影響力を持つかもしれない。」
昨年のシグナル伝達のブレイクスルーの一つは、抑制性マイクロRNAに対して競合する標的を提供することによって、本来のパートナー遺伝子の発現を亢進させる転写型偽遺伝子の役割を同定したものであった。Frumanが選出した2つ目の研究は、共通のマイクロRNA応答エレメント(MRE)を含む内因性RNA(mRNA、転写型偽遺伝子および長鎖非コードRNA)が、調節性マイクロRNAの限られたプールに対して競合することによって、トランスクリプトーム規模の調節ネットワークを形成するという仮説を支持する研究(9)であった。Karrethら(10)、Sumazinら(11)およびTayら(12)の研究を推薦するに当たり、Frumanはこのような競合する内因性RNA(ceRNA)のネットワークがどのように機能するかを説明し、がんと密接な関連がある可能性に注目した。「特定のマイクロRNAが3-UTRにコンセンサスMREを共有する複数のmRNAの発現を抑制することはすでに知られている。miRNAの標的となる遺伝子は、必ずしも共通の経路または共通の細胞機能にかかわるタンパク質をコードするわけではない。3つの論文は、共通のmiRNAが標的とするmRNAがお互いの発現を調節する競合相手、つまり「スポンジ」として作用することを示した(10-12)。これは膨大な示唆を含む画期的な概念上のブレイクスルーである。これらの論文はがんを取り上げ、腫瘍抑制因子PTENの発現が競合する複数の内因性RNA(ceRNAs)によって調節されることを示した。これらのceRNAをコードする遺伝子は、その欠損によってmiRNAを介するPTENのダウンレギュレーションを促進するので、腫瘍抑制因子として作用することができる。このような機能は、3'-UTRに依存しているが、このメッセージの機能をコードするタンパク質には依存しない。ある遺伝子のタンパク質産物がceRNAネットワークにおいて重要な役割を果たしている場合には、遺伝子ノックアウトまたはサイレンシング法によって、その遺伝子産物に腫瘍抑制または発がん機能があると誤って評価する可能性があることを今や認識すべきである。」ceRNAの発がんへの関与は明らかだが、その生理学的機能もまた解明されつつある。本シリーズにおける最後の選出として、FrumanはCesanaらの論文を推薦した。この論文は、筋特異的長鎖非コードRNAが、筋分化に関与する2つの転写因子を抑制するマイクロRNAと競合することによって、筋分化の時期を調節することを示唆したものである(13)。
次にGibsonが推薦した2つの論文は、真核生物の遺伝子発現の調節から転じて、原核生物における遺伝子調節に注目したものであった。「細菌の細胞は、しばしば「単なる酵素の袋」と言われてきた。私は原核生物における精巧な調節系の可能性を却下するという点で、この考え方がいかに馬鹿げているかを浮き彫りにした2つの論文を選出したい。細胞の複数の状態のパラメーターをモニタリングする精巧でネットワークを形成するシグナル伝達系が、原核生物の遺伝子調節に対して、極めて広範で、かつ極めて的確に作用することができるという考え方が広まりつつある。」1報目はNurmohamedら(14)の論文であり、トリカルボン酸回路の中間体であるクエン酸が、デグラドソームと呼ばれるRNA分解複合体を構成する成分の大腸菌ヌクレアーゼである、ポリヌクレオチドホスホリラーゼ(PNPase)と結合し、その活性を調節することを示すことによって、細菌の代謝とRNA安定性の直接的な関係を明らかにした(14)。逆に、PNPase活性の喪失は代謝に対して広範な影響を及ぼした。2報目はNevo-Dinurらの論文であり、大腸菌mRNAが翻訳とは無関係に、細胞の適切なドメインへと空間的にターゲッティングすることを示すことによって、細菌では転写と翻訳が厳密に共役しており、タンパク質の局在はそのタンパク質自体のターゲッティングシグナルにのみ依存するという一般的な見解に対して異議を申し立てた(15)。
再び、真核生物に戻り、Anselは胚発生の際に翻訳が調節される予想外の機構に注目を促し、Kondrashovら(16)の論文を推薦した。この研究は、リボソームの主要成分であるリボソームタンパク質L38が、Hoxタンパク質をコードするmRNAを含む転写産物サブセットの翻訳を選択的に調節することによって、脊椎動物の組織パターン形成において予期せぬ役割を果たすことを明らかにした。Snyderは、彼の後輩であるJing Xe、Juan SbodioおよびBindu Paulとともに、ある種の神経変性疾患の病理に寄与する可能性のある、通常と異なる翻訳様式を明らかにした研究を推薦して、次のように説明した。「いくつかの神経変性疾患、特にハンチントン病は、ポリグルタミン鎖をコードするCAGリピートと関連がある。Zuら(17)は、CAGリピートが増幅しているコンストラクトは、ATG開始コドン非存在下でもポリグルタミンや他の繰返しを有するタンパク質を発現すると報告している。これは、タンパク質翻訳の新たな様式を表していると考えられ、多様な神経変性病態におけるフォールディング異常タンパク質の蓄積に関与するかもしれない。」
分泌タンパク質と膜タンパク質のほとんどは小胞体(ER)内腔で折りたたまれる。折りたたまれなかった(フォールディングされなかった)タンパク質、あるいは誤って折りたたまれた(ミスフォールディングされた)タンパク質の小胞体内での蓄積は、もちろん、CAGリピートの増幅とは無関係に起こり、小胞体ストレス応答(UPR)と呼ばれるストレス応答を惹起する。UPRの一環として、小胞体の膜貫通タンパク質Ire1がストレスを感知し、小胞体のホメオスタシスの回復、それがうまくいかなければアポトーシス性の細胞死を引き起こすシグナル伝達経路を開始させる。しかし、Ire1を活性化するストレスシグナルは正確には何であろう。Dikicは、酵母においてフォールディングされなかったタンパク質自体がIre1に直接結合し、そのオリゴマー化および活性化を促進することを明らかにしたGradnerとWalter(18)の研究を推薦した。小胞体での過程と同様に、タンパク質のフォールディングは小胞体内に存在するカルシウムに依存する。別の小胞体膜貫通タンパク質であるSTIM1(間質相互作用分子1)は、小胞体におけるカルシウム貯蔵が枯渇した場合にカルシウム流入を促すカルシウムセンサーであることがわかっていた。Gillは、STIM1が温度の変化によっても活性化されることを示したXiaoら(19)の研究を推薦した。この研究は、前述の研究とともに、STIMタンパク質が細胞ストレスの一般的なセンサーとして働く可能性を示唆するものである。「この発見は、STIMタンパク質に画期的な予想外のセンサーとしての特性があることを示すものである。これらのタンパク質は小胞体内腔のカルシウムセンサーとしてもともとは発見されたのだが、意外にも小胞体と細胞膜の接合部位へと移行して、Oraiカルシウム流入チャネルとの間で重要な伝達を行なう。Ardem Patapoutianの研究室の研究によって、STIMタンパク質は適度な温度上昇を感知して、細胞内カルシウム貯蔵の枯渇がなくても活性化することが示された。しかし、高温では、Oraiチャネルを活性化させる共役は阻害されている。このことから、温度は、温度が正常値に下降した場合にOraiチャネルの活性化に備えるための機構であるか、あるいは高温では、脱共役過程によって細胞が過剰活性化状態にならないように保護すると考えられる。この過程は発熱中のリンパ球におけるシグナル伝達と関連が深いかもしれない。また、カルシウムストレスや温度ストレスだけでなく、活性酸素種、低酸素症および酸性化によるストレスにも応答して、STIMタンパク質が細胞ストレスのより一般的なセンサーとして機能することとより広範な関連がある。」
もちろん、細胞シグナル伝達におけるカルシウムの役割は有名である。Mikoshibaは、免疫細胞でのシグナル伝達における別の二価カチオン、マグネシウムの役割を明らかにした論文を推薦した。Liら(20)は、X染色体連鎖ヒトT細胞免疫不全とマグネシウム輸送体MAGT1をコードする遺伝子の突然変異の関係を明らかにした。機能解析によって、MAGT1の欠損はT細胞受容体(TCR)刺激後のマグネシウム流入の低下、およびTCR依存的なホスホリパーゼCγ1の活性化とカルシウム流入の障害と関連があることが示唆された。このように、マグネシウムは、T細胞シグナル伝達において細胞内セカンドメッセンジャーとして重要な役割を果たすようである。
VivierとDikicも、免疫機能の理解におけるブレイクスルーを推薦した。宿主と環境の間の障壁となる他の上皮と同様に、腸には上皮機能と局在的な防衛機能の維持を助ける特殊なリンパ球が存在する。Vivierは、自然免疫に関与する腸リンパ球サブセットにおけるアリル炭化水素受容体の植物に存在する栄養素による活性化が、リンパ球の増殖を促進し、それによって腸の免疫防御機構に寄与することを示したLiら(21)およびKissら(22)の研究を推薦した(23)(図2)。ユビキチン化は、小さなタンパク質のユビキチンが標的タンパク質に結合する翻訳後修飾である。ユビキチン化には単一分子が関与する場合(モノユビキチン化)と、様々なタイプのユビキチン鎖が関与する場合があり、ユビキチン化の形態が異なると惹起される応答も異なる。Dikicは「2011年のユビキチン分野におけるシグナル伝達で最も驚くべき発見」と述べ、Gerlachら(24)およびTokunagaら(25)の研究を推薦した。これらの研究は、直鎖状ユビキチン鎖が炎症および自然免疫応答の調節において中心的役割を果たしていることを証明した。このため、直鎖状ユビキチン鎖連結複合体(LUBAC)の構成成分を欠損するマウスは、炎症性皮膚病変を特徴とする慢性増殖性皮膚炎を伴う炎症性表現型を示す(24-26)。

図2
アブラナ科の野菜に含まれる植物化学物質由来リガンドがアリル炭化水素受容体を活性化し、腸内の免疫防御を促進する。
CREDIT: B. STRAUCH/SCIENCE SIGNALING
次の一連の推薦対象は、防御におけるシグナル伝達から疾患におけるシグナル伝達へと移る。Dohlmanは、Gαiを標的とするRGS(Gタンパク質シグナル伝達調節因子)タンパク質が心臓再同期化療法による心機能の回復に関与することを示唆したChkirら(27)の論文を推薦した。「心室同期不全を示す心不全患者は、両側同時ペーシングによって心臓を再同期化するように考案された電気刺激療法によって改善する。この療法は死亡率を下げるが、弱い心臓により多くの仕事をさせるという一見矛盾した方法で行なわれる。David Kassらの研究は、心臓の再同期化によってRGS2とRGS3の発現が亢進し、その機能が改善されることを明らかにした。RGSタンパク質が内因性GTPase活性を刺激することによってGタンパク質の不活化を促進することは以前から知られている。これらの発見から、RGSタンパク質が心不全における魅力的な治療標的であることが明らかである。より広い意味では、これらの発見は、有効な臨床治療を分解し、今後の治療に向けて重要な分子的変化を特定するリバース・エンジニアリングの一例であると言える。」
シグナル伝達の「愛好家」は、アポトーシス、壊死およびオートファジーなどの細胞死の様式に以前から精通している。Snyderが次に推薦したのは、NMDA型グルタミン酸受容体下流で起こり、様々な脳疾患の原因となる興奮毒性細胞死など、さまざまな病態への関連が示唆される特徴的な細胞死であるパータナトスに関する研究である。Snyderは、パータナトスを抑制するNMDA受容体の活性化に応答して誘導され、興奮毒性細胞死に関連する神経疾患の有望な治療法となり得るタンパク質を特定したAndrabiら(28)の論文を推薦した。「ValinaおよびTed Dawsonは、ポリADPリボース(PAR)が細胞死を媒介するという概念の草分けとなった。彼らは、神経保護作用を示し、PARとの直接的な結合によってPAR関連細胞死を選択的に障害することによって作用する新規タンパク質Idunaを特定した。」
Snyderは最後に、脳内のトリプトファン代謝物の存在量を変えることによって神経変性疾患を治療する有望な方法について報告したZwillingら(29)の論文を推薦した。キヌレニン経路は、トリプトファン分解の主要経路である。キヌレニン経路代謝物のキノリン酸はNMDA受容体アゴニストとして作用し、ハンチントン病の病態生理に寄与すると提唱されているのに対して、同経路の副反応を介して生成するキヌレン酸は虚血モデルにおいて神経保護作用を示す。キヌレン酸はキノリン酸による神経変性を抑制し、細胞外グルタミン酸濃度を低下させ、NMDA受容体のグリシンコアゴニスト部位を遮断する(図3)。Snyderは、この推薦に際して次のようにコメントした。「Robert Schwarczらは、トリプトファン代謝物であるキノリン酸とキヌレン酸がそれぞれ神経毒性物質および神経保護物質であると以前から主張してきた。彼らは今回、キヌレンモノオキシゲナーゼを阻害し、キヌレンの蓄積のキノリン酸の減少を引き起こすキヌレンのプロドラッグであるJM6について報告している。」血液脳関門を効率良く通過しない薬物は血球細胞のキヌレニンモノオキシゲナーゼを阻害し、脳へのキヌレンの輸送を促進し、脳内キヌレン酸を増大させ、細胞外グルタミン酸を減少させた。JM6はアルツハイマー病とハンチントン病のマウスモデルにおいて治療効果を示した。
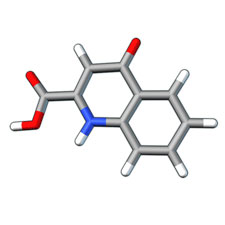
図3
キヌレン酸は神経保護作用を示す。
CREDIT: Y. HAMMOND/SCIENCE SIGNALING
神経病理の次は健全な脳に関する研究に移り、Mikoshibaは、アストロサイトが基底状態のシナプス伝達、すなわち単一の活動電位に応答して起こる個々のシナプスでの神経伝達物質の放出を検出し、そして調節することを明らかにしたPanatierら(30)の論文を推薦した。この推薦に際して、Mikoshibaは、シナプス伝達の理解に与える概念的進展だけでなく、著者らの技術的業績についても言及した。「Ca2+イメージングは、ニューロンのスパインにおいてかなり以前から用いられており、今では標準的な技術となっているが、アストロサイトの研究領域では明らかに遅れていた。著者らは、アストロサイトでも同様の解像度が得られることを示し、これを利用してシナプスの評価においてアストロサイトの役割に関する主な概念上の問題のいくつかに取り組んだ。本手法はすぐに他の主要な研究室でも採り入れられ、脳科学のさらなる進展に寄与するであろう。」Mikoshibaは、カルシウムシグナル伝達の研究に新たな方向性を示すと考えられる技術的業績に関する別の論文も推薦した。
細胞内カルシウムの変化を測定する蛍光指示薬は、このどこにでも存在するセカンドメッセンジャーが媒介するシグナル伝達に関して、多くの洞察を与えた。このような指示薬には、カルシウム感受性色素と遺伝子組換え蛍光タンパク質がある。Mikoshibaが指摘したように、「遺伝子にコードされたCa2+指示薬は、in vivoでも細胞活性をモニタリングする強力なツールで[あった]が色は緑だけ[であった]。」そして、2011年の最後のシグナル伝達のブレイクスルーには、異なる細胞内コンパートメントを標的とする複数の色の遺伝子コードCa2+指示薬で、同一細胞内の異なるコンパートメントのCa2+を異なる色で同時にイメージングすることを可能にし、「カラフルなCa2+イメージングの新時代」の到来を約束したZhaoら(31)の研究が推薦された(図4)。
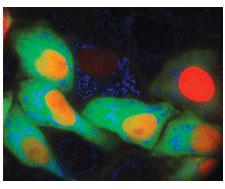
図4
様々な色の蛍光を発し、異なる細胞内コンパートメントを標的とするCa2+指示薬をトランスフェクトしたHeLa細胞
CREDIT: Y. ZHAO/UNIVERSITY OF ALBERTA AND S. ARAKI/HOKKAIDO UNIVERSITY
2012年1月3日号






