チューブリンはαチューブリンとβチューブリンと呼ばれる密接に関連した2つの55KDaタンパクから構成されるヘテロダイマーです。この2つのタンパクは、小さな遺伝子ファミリーとして、異なる遺伝子にそれぞれコードされ、その塩基配列は真核生物界で高度に保存されています。
したがって、ウシの脳組織から分離したチューブリンはいかなる真核生物から分離したチューブリンとも、かなり高いホモロジーがあります。この事実は、ウシのチューブリン(微小管の形、下図B参照)を、様々な種のタンパクアッセイに使用しても、多くの情報をもたらすことを示しています。以下にその文献例を示します。
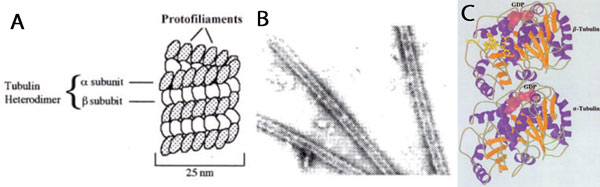
A 微小管の概要
B in vitroで形成したウシの微小管の電子顕微鏡写真(拡大率×100,000)
C Tubulin crystal structure developed using T237 Nogales et al1998. Nat. 391, p. 199-206.
出芽酵母 Saccharomyces Cerevisiae;
Hyman, A.A., Middleton, K.M., Centola, M., Mitchison, T.J., and Carbon, J. Microtubule-motor activity of a yeast centromere-binding protein complex. Nature 359, 533-536 (1993).
Jiang, W., Middleton, K.M., Yoon, H., Fouquet, C., and Carbon, J. An essential Yeast protein, CBF5, binds in vitro to centromeres and microtubules. Mol. Cell. Biol. August (1993).
Barnes, G., Louie, K.A., and Botstein, D. Yeast proteins associated with microtubules in vitro and in vivo. Mol. Biol. Cell. 3, 29-47.
ショウジョウバエ Drosophila melanogaster;
Walker, R.A., Salmon, E.D., and Endow, S.A. The Drosophila claret segregation protein is a minus-end directed motor molecule. Nature 347, 780-782 (1990).
Zhang, P., Knowles, B., Goldstein, L.S., and Hawley, R.S. A kinesin-like protein required for distributive chromosome segregation in Drosophila. Cell. 62, 053-062 (1990).























 このページを印刷する
このページを印刷する








 中身を見る
中身を見る 中身を見る
中身を見る 中身を見る
中身を見る
 中身を見る
中身を見る