
野中隆 先生

神経変性疾患の患者脳などに出現する細胞内異常タンパク質凝集体の形成メカニズムに関する新たな仮説が提唱されている。すなわち、アルツハイマー病(AD)におけるタウやパーキンソン病(PD)やレビー小体型認知症におけるαシヌクレインなどの異常蓄積による細胞内凝集体が、プリオン病における異常プリオンタンパク質と同様な性質を有し、細胞間を伝播し、伝播した先の細胞内で凝集体形成のシードとして機能することが示唆されている。この「凝集タンパク質の細胞間伝播」は、病状の進行に伴って異常病変が拡大していく現象を部分的に説明する可能性があり、国内外で非常に注目されているトピックスの一つである。ここで は、培養細胞やマウスを用いたαシヌクレインの細胞内蓄積モデルに関する我々の研究成果を紹介する。
1997年に南イタリアの家族性PD家系の遺伝学的解析によりαシヌクレインが原因遺伝子として同定され(1)、それとほぼ同時に、PD の特徴的な病理構造物であるレビー小体の主要構成成分としてαシヌクレインが同定された(2,3)。αシヌクレインは 140アミノ酸からなるポリペプチドであり、脳に多く存在する可溶性タンパク質であるが、その機能はあまりはっきりしていない。患者脳においてαシヌクレインはリン酸化およびユビキチン化を受けて蓄積・線維化しており、またレビー小体の出現部位は神経細胞脱落の部位とよく一致する。したがって、細胞内にαシヌクレインが蓄積することにより何らかの細胞毒性が生じ、その結果神経細胞死が誘導され、最終的に発症に至るというメカニズムが想定されている。
弧発性PD におけるレビー小体病変の広がりについて、Braakらは、レビー小体の出現は 迷走神経背側運動核より始まり、脳幹に沿って上行性に徐々に病変が拡がるという仮説を提 唱した(4,5)。これに対し、齊藤・村山らは、レビー小体病理は嗅球辺縁部から前嗅覚、さらに 扁桃核へと拡がるという経路を見いだした(6)。また実際の患者脳においてレビー小体病変が 伝播する可能性を最初に示したのは、胎児の中脳神経細胞を移植したPD患者脳の解析か ら、その移植部位のドパミン神経細胞にレビー小体が見いだされたという報告である(7,8)。 この結果から、ホスト側の PD患者の組織に存在するαシヌクレイン凝集体が移植片の神経細 胞に伝達され、本来レビー小体は存在しないはずの移植された神経細胞においてシード依存 的なαシヌクレイン蓄積が生じた可能性が考えられるようになった。
このように、患者脳においてシード依存的にαシヌクレインが細胞内で蓄積することが示唆されたが、それ以前から我々は、αシヌクレインが細胞内でシード依存的に蓄積する細胞モデルの構築を試みていた。
In vitro においてαシヌクレインがシード依存的に凝集するということはすでに明らかになっている。すなわち、リコンビナントαシヌクレインモノマーの溶液を37℃にて静置してもアミロイド線維の形成はほとんど生じないが、予め作製しておいたαシヌクレイン線維を静置したモノマー溶液中に添加すると、その線維形成が加速度的に進行する(9)。一方で、培養細胞に αシヌクレインを一過性に発現させても、ただ単に発現させただけでは細胞内蓄積は生じない。我々は、培養細胞においてもシード依存的なαシヌクレイン蓄積を再現しようと試行錯誤を重ね、2005年にその構築に成功した(10,11)。すなわち、予めαシヌクレインのプラスミドを一過性に発現した細胞に、in vitro で調製したリコンビナントαシヌクレインのアミロイド線維をプラスミドトランスフェクション試薬と共に処理すると、細胞外から導入された線維をシードとして、細胞内の可溶性αシヌクレインがシード依存的に細胞質内で凝集することを見いだした。これらの凝集体はリン酸化やユビキチン化といった蓄積αシヌクレインの特徴をも有しており、患者脳に見られるレビー小体を再現した細胞モデルと考えられる(図1)。このトランスフェクション試薬を利用したタンパク質線維の導入方法は応用性に富んでおり、αシヌクレインやタウなどのリコンビナントタンパク質からなる線維や凝集体を細胞内に導入できるだけでなく、実際の患者脳に蓄積したタンパク質画分(界面活性剤に不溶な画分)を細胞内に導入することも可能である。
さらにこのモデル細胞において、凝集体の形成から4〜5日経過した時点でネクローシス様の細胞死が生じていることを確認した。また細胞内αシヌクレインの蓄積を伴う細胞では、プロテアソーム活性が抑制されており、この抑制と細胞死誘導には何らかの関連性が存在すると考えられる(11)。
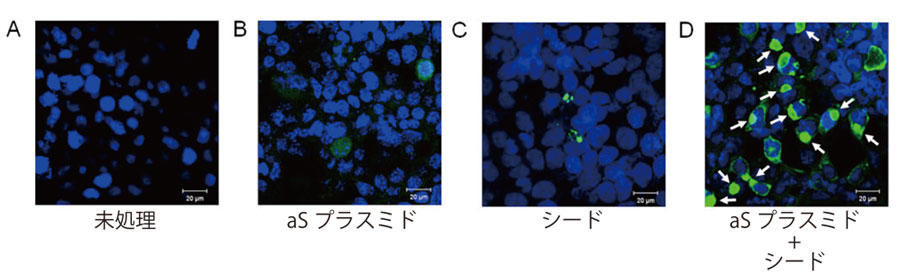
図1. シード依存的な細胞内αシヌクレイン蓄積の培養細胞モデル
A:未処理の細胞
B:αシヌクレイン(aS)のプラスミドを一過性発現した細胞
C:αシヌクレイン線維(シード)をリポフェクトアミンと共に処理した細胞
D: 予めプラスミドを一過性に発現した細胞に、シードをリポフェクトアミンと共に処理した細胞
いずれのサンプルも、リン酸化αシヌクレイン特異抗体で免疫染色(緑色)を行い、核を TO-PRO-3 で染色した(青色)。αシヌクレインは細胞に一過性に 発現しただけではリン酸化はほとんど受けないので (A) においてはほとんど何も染色されていない。また (C) では、導入されたシードが細胞内でリン酸化され、ドット状に染色された。予めαシヌクレインのプラスミドを発現した細胞にシードを処理すると (D)、リン酸化αシヌクレイン抗体に陽性な細胞内凝集体(矢印)が多数観察される。いずれも直径は約10 µmである。スケールバーは20 µm。文献11より抜粋・改変。
不溶化したタンパク質をシードとして細胞内に導入するというこの方法は、培養細胞だけでなく実験動物にも応用できることが容易に考えられる。そこで、我々は野生型マウス脳にリコンビナントヒトαシヌクレインモノマーや線維、あるいはマウスαシヌクレイン線維をシードとして注入し、マウス脳においてもシード依存的にαシヌクレインが蓄積するかどうかについて検討した。シードを接種して15ヶ月経過した後にマウス脳を摘出し免疫組織化学的に解析したところ、シード接種群において異常リン酸化を受けたαシヌクレインの蓄積さらには伝播が、接種側だけでなくその反対側においても誘導されることを見いだした(図2)(12)。また生化学的解析より、接種したヒトαシヌクレイン線維がマウス脳に蓄積しているのではなく、内在性のマウスαシヌクレインがリン酸化およびユビキチン化を受けて蓄積していることを明らかにした。この結果は、マウス脳においても、シード依存的にαシヌクレインが蓄積・凝集することを示している。さらにシードとしてマウスαシヌクレイン線維を接種した群では、αシヌクレイン蓄積の病理の出現頻度、非接種側への伝播頻度がヒト線維接種群に比べて高かったことから、αシヌクレインの伝播に「種の壁」が存在すると言える。一方、モノマー接種群ではαシヌクレインの蓄積・伝播は認められなかった。さらに我々は、αシヌクレイン線維の接種部位により異常病理の出現部位が変化すること、すなわち、接種部位と神経連絡のある部位に病理が伝播することから、αシヌクレイン線維の一部はシナプスを介して細胞から細胞へと伝播する可能性を示した(13)。
近年、我々のグループだけでなく他の研究グループからも、神経変性疾患の患者脳に蓄積する異常タンパク質が、異常プリオンタンパク質のように神経細胞間を伝播する可能性が示唆されている。この異常タンパク質の伝播の可能性は、AD や PD における異常病変が規則的に拡がる現象をある程度説明しうるものであり、その実証過程においては慎重に議論を進める必要はあるが、非常に興味深い可能性であることは言うまでもない。これまで、神経変性疾患の治療戦略において、中枢神経系における異常タンパク質の「最初の蓄積」を抑制することを念頭にした基礎研究が展開されてきたように思うが、この異常タンパク質の伝播の可能性を考慮すると、必ずしも最初の凝集体形成ステップを抑制することに拘ることはなく、その後の凝集体が細胞間を伝播するステップを抑制することも治療のターゲットになり得ると考えられる。
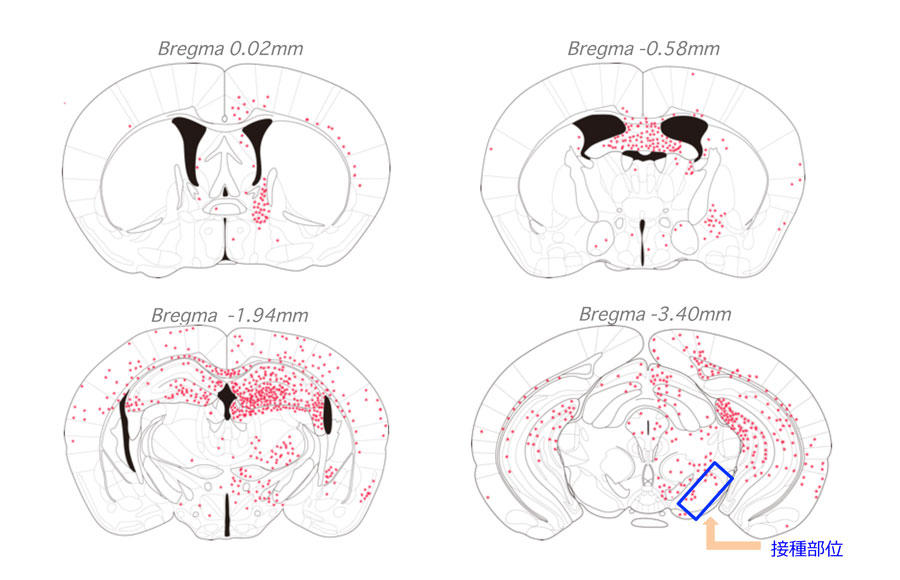
図2. ヒトαシヌクレイン線維を接種したマウスの脳における異常病理の出現部位
ヒトαシヌクレイン線維を黒質に接種し、15ヶ月後に脳を摘出して抗リン酸化αシヌクレイン抗体による免疫染色を行った。その結果、接種部位の黒質周辺だけでなく、それより離れた皮質などの部位や、非接種側である左半球にも病理の拡がりが見られた。文献12より抜粋・改変。
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について
© COSMO BIO