

リジンのアセチル化 - 多様な細胞プロセスの制御因子
リジンのアセチル化は、多くの真核生物タンパク質の機能や局在を調節するために重要な翻訳後修飾(PTM)です。このPTMは可逆的で、ヒストン脱アセチル化酵素(HDACs)やヒストンアセチル化酵素(HATs)によって調節されます。リジンのアセチル化は、1968年にウシ胸腺ヒストンではじめて報告されました1。その後の10年間に、HMG1タンパク質(high mobility group protein 1)、α-チューブリン、腫瘍抑制因子 P53 のような非ヒストンタンパク質において、リジンがアセチル化されることが示されました2-4。アセチル化リジン抗体が開発され、抗体を質量分析法に使用するようになったことで、リジンのアセチル化部位についての大規模なプロテオーム研究が行われ、これまで把握されていなかったアセチル化タンパク質の数が明らかにされました。最初の研究では、Hela細胞の細胞質画分中に37、マウス肝ミトコンドリアに 133のアセチル化タンパク質が特定されました5。さらに最近の研究では、ラット組織を使用して、4,541のタンパク質で15,474の修飾部位が同定されました6。この研究で、リジンがアセチル化されたタンパク質の大半が細胞質 (30%) と核 (30%) に局在し、残りはミトコンドリア (15%)、形質膜 (15%)、小胞体またはゴルジ体 (5%)、細胞外領域 (5%) に存在することが明らかになりました6。今回は、細胞プロセスを調節するリジンのアセチル化の例について特集します。
リジンのアセチル化は、細胞骨格関連タンパク質(例: アクチン、チューブリン、低分子量GTPase)の調節に重要な役割を果たしています。β-アクチンとγ-アクチンから構成されるストレスファイバーは、細胞の形状や運動において重要です。筋細胞では、α-アクチンがマイクロフィラメントを構成して、ミオシンと共に筋収縮を発生させ、非筋細胞では原形質流動を起こします。3つのアクチンアイソフォームは、いずれもアセチル化されます5,7。また、アクチン細胞骨格の調節タンパク質には、アセチル化によって修飾されるものがあります。例えば、アクチン重合核形成に重要なArp2/3 複合体のいくつかのサブユニットは、アセチル化されます7。他の研究では、HAT P300 または PCAFによってアセチル化される、コルタクチンの9種類のリジン残基が同定されました。コルタクチンがアセチル化されると、細胞周辺への移行が阻害され、アクチンへの結合能が減少することから、アクチンダイナミクスの低下や細胞運動の変化が起こります8,9。逆に、コルタクチンが成長因子で刺激された Rac1 の活性化を介して脱アセチル化されると、細胞質基質から細胞周辺へ移行し、F-アクチンと相互作用してその形成を促進します10,11。Rac1などのRhoファミリーGTPase は、葉状仮足、糸状仮足、アクチンストレスファイバーを形成するアクチンダイナミクスの調節に重要な役割を担っています。これらのG-タンパク質の活性化は、GDIs(GDP解離阻害剤)を含む様々なタンパク質によって、厳密に調節されています。RhoGDI-α のアセチル化は、Rho ファミリーメンバーに対する阻害作用を抑制することから、ストレスファイバーや糸状仮足の形成が促進されます5。 RhoA タンパク質は、接着分子カドヘリンと複合体を形成する p120 カテニンによっても阻害されます。p120 カテニンは少なくとも3つのリジンがアセチル化されています。このアセチル化は、細胞内局在の変化や、RhoAの阻害に関して重要です5,12。アクチンやGTPaseと同様に、細胞骨格タンパク質であるチューブリンもアセチル化されます。アセチル化部位はα-チューブリンの Lys40 残基です3。チューブリンのアセチル化によって微小管が安定化し、束化がより効率的に行われることが分かっています13,14。微小管は細胞輸送において(特に、長く進展した軸索や樹状突起を持つ神経細胞で)重要です。チューブリンがアセチル化されると、キネシンとダイニン両方による微小管輸送が促進されます15。
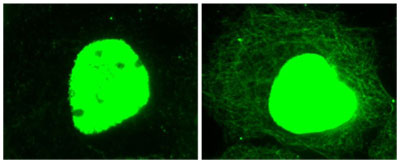
図1 ヒト類表皮がん A431 細胞を TSA 処理(右: 5 µM、12 時間)または未処理(左)後、抗アセチル化リジン抗体で染色した。 細胞質や核内のアセチル化タンパク質を、緑色蛍光で可視化した。未処理のコントロールとは対照的に、TSA処理した細胞では細胞質のアセチル化微小管ネットワークがはっきりと確認できる。核の蛍光強度は、核内のアセチル化タンパク質量を示す。
リジンのアセチル化部位は、構造タンパク質以外にヒストン修飾や転写調節に関係しないシグナル伝達タンパク質にもあります。例えば、Mdm2、Ku70、Stat3、Smad7、Hsp90 などです。Mdm2 は、腫瘍抑制タンパク質 p53 のユビキチン化およびプロテアソーム分解を促進する、RING finger E3 ユビキチンリガーゼです。Mdm2 がアセチル化されると、p53のユビキチン化およびプロテアソーム分解促進機能が抑制されます16。興味深いことに、p53自身もアセチル化され、p53を介したストレス応答に関わる p53-Mdm2 相互作用の不安定化が起こります17。Ku70 のアセチル化は、Ku70/Bax 複合体からの Bax の解離を促進し、遊離した Bax はミトコンドリアに局在しアポトーシスを引き起こします18。
リジンのアセチル化は、タンパク質の機能に影響する以外に、(特に核内輸送と核外輸送の際に)タンパク質の細胞内局在を調節します。興味深いことに、いくつかのタンパク質はアセチル化によって細胞質に局在化します19,20。一方、アセチル化によって核内にとどまるタンパク質もあります21,22。アセチル化が細胞内局在を調節するメカニズムは、特定の場所に局在化する結合パートナーとの相互作用の変化(例: p53-Mdm2 の相互作用)、または、核内輸送/核外輸送因子との相互作用の変化、のいずれかです。例えば、アデノウイルス形質転換タンパク質(E1A)内のカルボキシル末端核局在化シグナル(NLS)の Lys239 がアセチル化されると、インポーチン-αとの相互作用が弱まり、細胞質への局在化が促進されます23。逆に、NLS の肝細胞核因子-4(HNF-4)は核内にとどまるために重要で、CRM-1経路を介して細胞質への輸送を抑制します24。
結論
リジンのアセチル化は、遺伝子転写などのDNA依存的な核プロセスの調節において、重要な役割を果たすことがよく知られています。プロテオミクス研究によって、リジンがアセチル化される可能性のある多くの基質が同定されました。そのうちの大部分は細胞質に存在することから、重要な細胞経路の調節への関与が示唆されます。しかし、それらの多くは、まだ機能が明らかになっていません。
参考文献
1. Vidali G. et al. 1968. Chemical studies of histone acetylation. The distribution of epsilon-N-acetyllysine in calf thymus histones. J. Biol. Chem. 243, 6361-6366.
2. Sterner R. et al. 1979. Studies of acetylation and deacetylation in high mobility group proteins. Identification of the sites of acetylation in HMG-1. J. Biol. Chem. 254, 11577-11583.
3. L’Hernault S.W. and Rosenbaum J.L. 1985. Chalamydomonas alpha-tubulin is posttranslationally modified by acetylation on the epsilon-amino group of a lysine. Biochemistry. 24, 473-478.
4. Gu W. and Roeder R.G. 1997. Activation of p53 sequence-specific DNA binding by acetylation of the p53 C-terminal domain. Cell. 90, 595-606.
5. Kim S.C. et al. 2006. Substrate and functional diversity of lysine acetylation revealed by a proteomics survey. Mol. Cell. 325, 607-618.
6. Lundby A. et al. 2012. Proteomic analysis of lysine acetylation sites in rat tissues reveals organ specificity and subcellular patterns. Cell Rep. 2, 419-431.
7. Choudhary C. et al. 2009. Lysine acetylation targets protein complexes and co-regulates major cellular functions.Science. 325, 834-840.
8. Zhang X. et al. 2007. HDAC6 modulates cell motility by altering the acetylation level of cortactin. Mol. Cell. 27, 197-213.
9. Zhang Y. et al. 2009. Deacetylation of cortactin by SIRT1 promotes cell migration. Oncogene. 28, 445-460.
10. Weed S.A. et al. 1998. Translocation of cortactin to the cell periphery is mediated by the small GTPase Rac1. J. Cell Sci. 111, 2433-2443.
11. Weed S.A. et al. 2000. Cortactin localization to sites of actin assembly in lamellipodia requires interactions with F-actin and the Arp2/3 complex. J. Cell Biol. 151, 29-40.
12. Anastasiadis P.Z. et al. 2000. Inhibition of RhoA by p120 catenin. Nat. Cell Biol. 2, 637-644.
13. Hubbert C. et al. 2002. HDAC6 is a microtubule-associated deacetylase. Nature. 417, 455-458.
14. Matsuyama A. et al. 2002. In vivo destabilization of dynamic microtubules by HDAC6-mediated deacetylation. EMBO J. 21, 6820-6831.
15. Dompierre J.P. et al. 2007. Histone deacetylase 6 inhibition compensates for the transport deficit in Huntington’s disease by increasing tubulin acetylation. J. Neurosci. 27, 3571-3583.
16. Wang X. et al. 2004. Inhibition of p53 degradation by Mdm2 acetylation. FEBS Lett. 561, 195-201.
17. Tang Y. et al. 2008. Acetylation is indispensable for p53 activation. Cell. 133, 612-626.
18. Cohen H.Y. et al. 2004. Acetylation of the C terminus of Ku70 CBP and PCAF controls Bax-mediated apoptosis. Mol. Cell. 13, 627-638.
19. Bari M.G. et al. 2006. C-Abl acetylation by histone acetyltransferases regulates its nuclear-cytoplasmic localization.EMBO Rep. 7, 727-733.
20. Valacco M.P. et al. 2006. Cell growth-dependent subcellular localization of p8. J. Cell. Biochem. 97, 066-1079.
21. Thevent L. et al. 2004. Regulation of human SRY subcellular distribution by its acetylation/deacetylation. EMBO J.23, 3336-3345.
22. Naryzhny S.N. and Lee H. The post-translational modifications of proliferating cell nuclear antigen: acetylation, not phosphorylation, plays an important role in the regulation of its function. J. Biol. Chem. 279, 20194-20199.
23. Madison D.L. et al. 2002. Acetylation of the adenovirus-transforming protein E1A determines nuclear localization by disruption with importin-alpha. J. Biol. Chem. 277, 38755-38763.
24. Soutglou E. et al. 2000. Acetylation regulates transcription factor activity at multiple levels. Mol. Cell. 5, 745-751.
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Acetyl Lysine, (Mouse) , 3C6.08.20 |
CYT | AAC01 | 200 UL [2 x 100 μl] |
¥114,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について






















 このページを印刷する
このページを印刷する








 中身を見る
中身を見る 中身を見る
中身を見る 中身を見る
中身を見る
 中身を見る
中身を見る