

翻訳後修飾のアセチル化による微小管の安定化
チューブリンの翻訳後修飾(PTM)のひとつであるアセチル化は、主に微小管集合体のα-チューブリン上の第40位リジン残基(Lys40)において生じます1-3。重要なα-チューブリンアセチルトランスフェラーゼにTAT1/MEC-17があります4,5。アセチル化チューブリンの脱アセチル化は、ヒストン脱アセチル化酵素6(HDAC6)や、silent information regulator 2/sirtuin type 2の哺乳動物相同体であるSIRT2により媒介されます6,7。Lys40は長期にわたり唯一のアセチル化部位と考えられてきました。プロテオーム解析によるとα-チューブリンやβ-チューブリン上の他のリジン残基がアセチル化の標的であるのに対して、機能解析では微小管内腔内のLys40残基に焦点が当てられています2,8,9。本稿では、チューブリンアセチル化、微小管安定性、およびアセチル化された微小管の機能性に関して討論します(図1)。
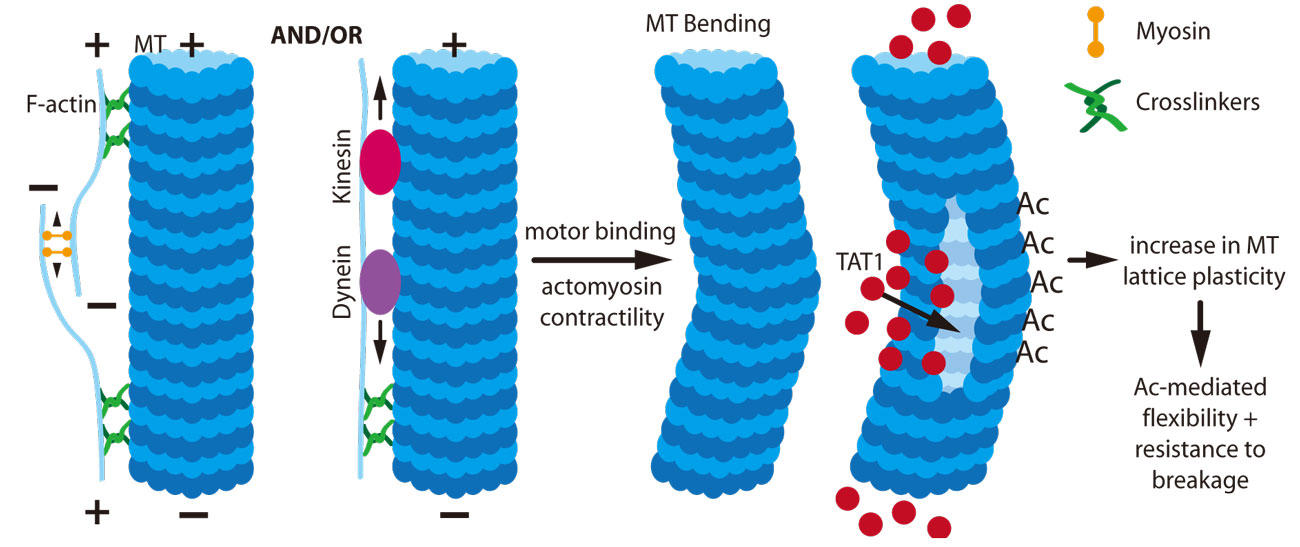
図1. アセチル化(Ac)が誘導する微小管安定化
アクトミオシン収縮性やモーター結合により力学的負荷が生じ、微小管が折り曲げられTAT1の侵入が可能となる。TAT1がリジン残基をアセチル化することで微小管格子の可塑性が増大し、微小管が柔軟になって壊れにくくなる。
アセチル化された微小管と安定性
アセチル化は、安定化された、半減期が数時間の長命な微小管(定義は、ノコダゾールやコルヒチン誘導性脱重合に対して耐性である微小管)のマーカーです10。注目すべき点として、アセチル化それ自体は微小管の安定化を誘導しないことが挙げられます10-15。しかし、近年の遺伝子破壊研究より、哺乳動物細胞においてLys40のアセチル化が、微小管を長命にさせて、かつ安定化させることに必要であることが強く示唆されています。通常はノコダゾール処理して微小管の重合を阻害しても、アセチル化微小管は安定的に存在できますが、TAT1を欠損させると、この安定した微小管が欠損することが確認されました16。逆に、TAT1過剰発現によりノコダゾール耐性(安定)微小管が著しく増大し、チューブリン脱アセチル化酵素であるHDAC6を欠損する線維芽細胞には、より多くのノコダゾール耐性微小管が存在していました。成長過程の神経と成熟した神経の両方でみられるように6,4,15、チューブリンのアセチル化は動的微小管の亜集団(半減期が数分)にも見られることから14、アセチル化は安定化した微小管に限定されるという従来の考え方は近年覆されています。
アセチル化により安定化された微小管の機能的な重要性
アセチル化により安定化された微小管はさまざまな細胞種で確認されており、数々の細胞内組織を構成し14、数多くの生理学的な細胞機能を担っています。毛様体形成、細胞周期、および細胞シグナル伝達を始め14、神経細胞発生や神経細胞移動、タンパク質のシナプス標的およびキネシンやダイニンのモーター結合や活性においても役割を担っています6,14。さらに、アセチル化された微小管は神経変性疾患において神経機能/機能障害や細胞内輸送などと関係があると考えられています14。
これらの多様な生理学的研究にも関わらず、アセチル化により長命になり、安定化された微小管の機能的な意義はまだよくわかっていません。その役割に関しては矛盾する結果が得られており、アセチル化がチューブリン重合に関与している可能性もあります。初期の研究によると、脱重合や重合へのアセチル化の影響はみつけられませんでした17。同様に、網膜色素上皮細胞におけるTAT1欠損は、微小管の重合や組織化に顕著な影響を与えませんでした16。一方、近年の研究18より、アセチル化チューブリンのヘテロ二量体では、自発的な重合核形成の比率が低減し、脱アセチル化チューブリンに比べて自己集合が著しく遅いことが確認されました18。単一微小管の動態から、アセチル化は成長速度に何の変化も与えないものの、アセチル化微小管は脱アセチル化微小管に比べて迅速に脱重合することが分かりました18。微小管の原繊維間の側方相互作用が、アセチル化により刺激されて崩壊するために、重合核形成と自己集合が変化します。これにより重合核形成率が低減して収縮(脱重合)が加速します。アセチル化が原繊維の相互作用に影響している理由は、安定された微小管が物理的ストレスに対する応答をするときに、アセチル化が一役買っているからです(図1)。
長命で安定化された微小管は、キネシンとダイニンのモーター結合による圧縮やアクトミオシン収縮性といった物理的ストレスによるねじれを受けます19,20(図1)。in vitroでは、アセチル化により微小管が物理的ストレスから保護されることから18、圧縮を受けて折れ曲がらないように、アセチル化が局在的に起こり、安定化された微小管を物理的ストレスから保護することが示唆されます16。TAT1欠損細胞では、物理的ストレスを受けて破損が増えることにより、長命の微小管が減少します。微小管を圧縮させるもので、一番多いのはRho/ROCKが介在するアクトミオシンの収縮であり、次にノコダゾールが誘導する微小管の脱重合が続きます16,21。モーター結合も圧縮の要因となります。アセチル化により、原繊維間相互作用が弱まることで微小管の曲げ剛性(曲げへの耐性など)が低減し、微小管が物理的に安定化されます18。これにより微小管格子の可塑性が増大し、繰り返し受ける物理的ストレスによる損傷の度合いが低減します(図1)。折れ曲がる微小管部分には格子の隙間があり、物理的ストレス/収縮が生ずるとその隙間が大きくなり、微小管内腔にTAT1が侵入できるようになります。また、ここでは折れ曲がり部分(ストレスを受けている微小管領域)においてα-チューブリンのアセチル化が生じ、微小管の痛んだ部分が保護されます16,22。TAT1がいったん微小管内腔に入ると、アセチル化標的部位に対する親和性や接近性によって、または格子内での局在化によって、TAT1の動きは制御されます22(図1)。
まとめ
チューブリンのアセチル化は、多様な細胞構造や細胞種において確認されており、安定化微小管が受ける物理的ストレスをはじめ無数の複雑な細胞機能と関係付けられています。Cytoskeleton社では、細胞内アセチル化を高感度かつ定量的に測定できるSignal Seeker™ Acetyl-Lysine Enrichment Kitをはじめ、内在性の翻訳後修飾の段階を研究する試薬をご提供しています。
参考文献
- Wloga D. and Gaertig J. 2010. Post-translational modifications of microtubules. J. Cell Sci. 123, 3447-3455.
- Janke C. and Kneussel M. 2010. Tubulin post-translational modifications: encoding functions on the neuronal microtubule cytoskeleton. Trends Neurosci. 33, 362-372.
- Hammond J. et al. 2008. Tubulin modifications and their cellular functions. Curr. Opin. Cell Biol. 20, 71-76.
- Akella A.J. et al. 2010. MEC-17 is an alpha-tubulin acetyltransferase. Nature. 467, 218-222.
- Shida T. et al. 2010. The major alpha-tubulin K40 acetyltransferase alphaTAT1 promotes rapid ciliogenesis and efficient mechanosensation. Proc. Natl. Acad. Sci. U.S.A. 107, 21517-21522.
- Fukushima N. et al. 2009. Post-translational modifications of tubulin in the nervous system. J. Neurochem. 109, 683-693.
- Garnham C.P. and Roll-Mecak A. 2012. The chemical complexity of cellular microtubules: Tubulin post-translational modification enzymes and their roles in tuning microtubule functions. Cytoskeleton. 69, 442-463.
- Choudhary C. et al. 2009. Lysine acetylation targets protein complexes and co-regulates major cellular functions. Science. 325, 834-840.
- Nogales E. et al. 1998. Structure of the alpha beta tubulin dimer by electron crystallography. Nature. 391, 199-203.
- Palazzo A. et al. 2003. Tubulin acetylation and cell motility. Nature. 421, 230.
- Li R. and Gundersen G.G. 2008. Beyond polymer polarity: how the cytoskeleton builds a polarized cell. Nat. Rev. Mol. Cell Biol. 9, 860-873.
- Piperno G. et al. 1987. Microtubules containing acetylated alpha-tubulin in mammalian cells in culture. J. Cell Biol. 104, 289-302.
- Wilson P.J. and Forer A. 1997. Effects of nanomolar taxol on crane-fly spermatocyte spindles indicate that acetylation of kinetochore microtubules can be used as a marker of poleward tubulin flux. Cell. Motil. Cytoskeleton. 37, 20-32.
- Perdiz D. et al. 2011. The ins and outs of tubulin acetylation: More than just a post-translational modification?. Cell. Signal. 23, 763-771.
- Witte H. et al. 2008. Microtubule stabilization specifies initial neuronal polarization. J. Cell Biol. 180, 619-632.
- Xu Z. et al. 2017. Microtubules acquire resistance from mechanical breakage through intralumenal acetylation. Science. 356, 328-332.
- Maruta H. et al. 1986. The acetylation of alpha-tubulin and its relationship to the assembly and disassembly of microtubules. J. Cell Biol. 103, 571-579.
- Portran D. et al. 2017. Tubulin acetylation protects long-lived microtubules against mechanical ageing. Nat. Cell Biol. 19, 391-398.
- Bicek A.D. et al. 2009. Anterograde microtubule transport drives microtubule bending in LLC-PK1 epithelial cells. Mol. Biol. Cell. 20, 2943-2953.
- Gupton S.L. et al. 2002. Converging populations of f-actin promote breakage of associated microtubules to spatially regulate microtubule turnover in migrating cells. Curr. Biol. 12, 1891-1899.
- Chang Y.C. et al. 2008. GEF-H1 couples nocodazole-induced microtubule disassembly to cell contractility via RhoA. Mol. Biol. Cell. 19, 2147-2153.
- Coombes C. et al. 2016. Mechanism of microtubule lumen entry for the a-tubulin acetyltransferase enzyme aTAT1. Proc. Natl. Acad. Sci. U.S.A. 113, E7176-E7184.
Signal Seeker™タンパク質濃縮キット
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Signal-SeekerTM Acetyl-Lysine Detection Kit |
CYT | BK163-S | 10 ASSAY |
¥112,000 |
Signal-SeekerTM Acetyl-Lysine Detection Kit |
CYT | BK163 | 30 ASSAY |
¥210,000 |
| Signal-SeekerTM Phosphotyrosine Detection Kit | CYT | BK160-S | 10 ASSAY |
¥112,000 |
| Signal-SeekerTM Phosphotyrosine Detection Kit | CYT | BK160 | 30 ASSAY |
¥221,000 |
| Signal-SeekerTM Ubiquitin Detection Kit | CYT | BK161-S | 10 ASSAY |
¥112,000 |
| Signal-SeekerTM Ubiquitin Detection Kit | CYT | BK161 | 30 ASSAY |
¥221,000 |
| Signal-SeekerTM SUMOylation Detection Kit | CYT | BK162-S | 10 ASSAY |
¥112,000 |
| Signal-SeekerTM SUMOylation Detection Kit | CYT | BK162 | 30 ASSAY |
¥221,000 |
PTM抗体、ビーズ、その他
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Acetyl Lysine (Mouse)  |
CYT | AAC02 | 2*100 UL |
¥114,000 |
Anti Acetyl Lysine (Trial size) (Mouse)  |
CYT | AAC02-S | 1*25 UL |
¥32,000 |
Anti Acetyl Lysine (Mouse)  |
CYT | AAC03 | 2*100 UL |
¥114,000 |
Anti Acetyl Lysine (Trial size) (Mouse)  |
CYT | AAC03-S | 1*25 UL |
¥32,000 |
Anti Acetyl Lysine (Mouse) Horseradish Peroxidase |
CYT | AAC03-HRP | 1*100 UL |
¥130,000 |
Anti Acetyl Lysine (Trial size) (Mouse) Horseradish Peroxidase |
CYT | AAC03-HRP-S | 1*25 UL |
¥43,000 |
Anti Acetyl Lysine Affinity Beads (Mouse)  |
CYT | AAC04-BEADS | 4*500 UL |
¥176,000 |
Anti Phosphotyrosine Affinity Beads, (Mouse) , 27B10.4 |
CYT | APY03-BEADS | 4*300 UL |
CYT社 APY03BEADS 4*330 を参照 |
| Anti SUMO-2/3 Affinity Beads, (Mouse) , 11G2 | CYT | ASM24-BEADS | 800 UL [2 x 400 μl] |
¥176,000 |
Ubiquitin Affinity Beads |
CYT | UBA01 | 40 RXN [4x420 ul] |
販売終了 |
Control for Ippt IgG beads |
CYT | CIG01-BEADS | 10 ASSAY |
¥32,000 |
| Control for Ubiquitin Affinity Beads | CYT | CUB01 | 10 ASSAY |
販売終了 |
【商品情報】
- アセチルリジン マウスモノクローナル抗体[CYT]
- 翻訳後修飾されたアセチル化リジンを幅広く検出 - SUMO-2/3 アフィニティービーズ[CYT]
- 免疫沈降(IP)によるSUMO化タンパク質の濃縮に最適
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する








 中身を見る
中身を見る 中身を見る
中身を見る 中身を見る
中身を見る
 中身を見る
中身を見る