参考文献
1. Amerik et al., (1997). EMBO J. 16, 4826-4838.
2. Behrens et al., (1998). Science 280, 596-599.
3. Berezutskaya et al., (1997). J. Biol. Chem. 272, 30135-30140.
4. Boyer et al., (1996). Cancer Res. 56, 4620-4624.
5. Brehm et al., (1999) J. Cancer (Supplement 1)80, 38-41.
6. Chen et al., (1997). J. Biol. Chem. 272, 24081-24087.
7. Doherty et al., (1987). Biochem. J. 241, 793-800.
8. Earl et al., (1987). Biochem. J. 241, 809-815.
9. Freed et al., (1999). Genes and Develop. 13, 2242-2257.
10. Gerards et al., (1998). J. Mol. Biol. 275, 113-121.
11. Glas et al., (1998). Nature 392, 618-622.
12. Glickman et al., (1998). Cell 94, 615-623.
13. Groettrup et al., (1997). Cancer Gene Therapy 4, 308-309.
14. Hicke(1999). Trends in Cell Biol. 9, 107-112.
15. Higashitsuji et al., (1999). Nature Medicine.
16. Hiller et al., (1996). Science 273, 1725-1728.
17. Hiyami et al., (1999). J. Biol.Chem. 274, 28019-28025.
18. Hofmann et al., (1999). Cell 96, 645-653.
19. Jensen et al., (1998). Oncogene 16, 1097-1112.
20. Joazeiro et al., (1999) Science 286, 309-312.
21. Johnston et al., (1998). J. Cell Biol. 143, 1883-1898
22. Kaelin et al., (1998). Trends in Genetics 14, 423-426.
23. King et al., (1996). Science 274, 1652-1659.
24. Lam et al., (1997). Nature 385, 737-740.
25. Laszlo et al., (1991). J. Pathol. 164, 203-214.
26. Liakopoulos et al., (1998). EMBO J. 17, 2208-2214.
27. Lorick et al., (1999). Proc. Natl. Acad. Sci. 96, 11364-11369.
28. Lupas et al., (1997) Trends In Biochemical Sciences 22, 399-404.
29. Matunis et al., (1996). J. Cell Biol. 135, 1457-1470.
30. Mayer et al., (1998). Folding and Design 3, R97-R99.
31. Mayer et al., (1999). In Proteasomes, D. Wolf and W. Hilt, eds.( Berlin:Springer-Verlag).
32. Mizushima et al., (1998). Nature 395, 395-398.
33. Mizushima et al., (1998). J. Biol. Chem. 273, 33889-33892.
34. O'Brien et al., (1999). Science 286, 458-481.
35. Schmidtke et al., (1996). EMBO J. 15, 6887-6898.
36. Shintani et al., (1999). EMBO J. 18, 5234-5241.
37. Tamura et al., (1998). Cell 95, 637-648.
38. Terrell et al., (1999). Mol. Cell 1, 193-202.
39. Tomkinson et al., (1999). Sciences 24, 355-359.
40. Wigley et al., (1999). J. Cell Biol. 145, 481-490.
41. Yaron et al., (1997). EMBO J. 16, 6486-6494.
42. Zhu et al., (1996). Proc. Natl Acad. Sci. 93, 3275-3279.
43. Zhu et al., (1997). J. Biol. Chem. 272, 51-57.























 このページを印刷する
このページを印刷する
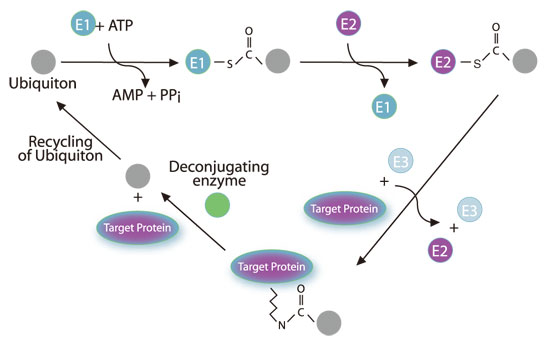
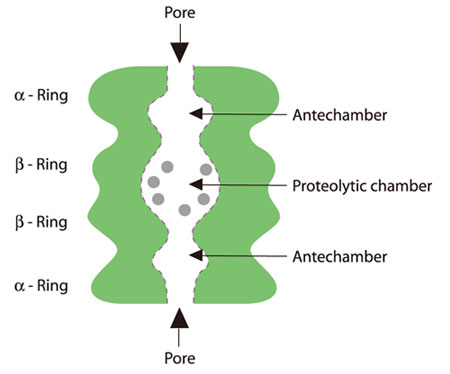
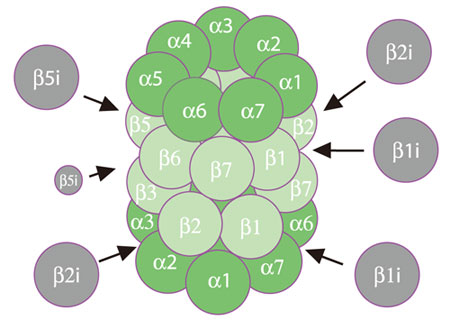
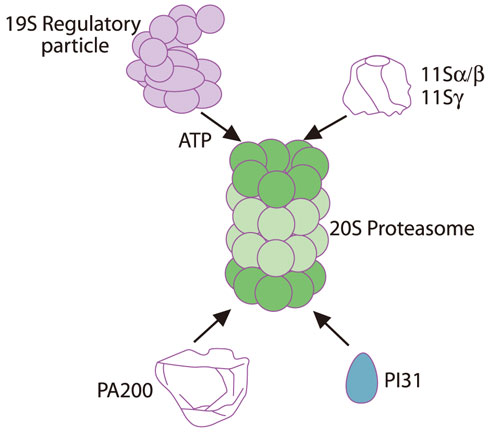








 中身を見る
中身を見る 中身を見る
中身を見る 中身を見る
中身を見る
 中身を見る
中身を見る