レニン(ヒトリコンビナント/活性型)は、アンジオテンシノーゲン(アンギオテンシノーゲン)を切断してアンジオテンシン I を生成させる、特異性の高い活性型酵素です。
アンジオテンシノーゲンを切断してアンジオテンシン I を生成 レニン(ヒトリコンビナント/活性型)
- カテゴリから探す > 生理活性物質 > その他の生理活性物質
- カテゴリから探す > シグナル伝達 > メタボリックシンドローム > 高血圧、高血糖、高脂血症
- 研究分野から探す > 代謝 > 腎機能測定
背景
レニン
レニンは、身体のレニン-アンジオテンシン系(RAS)に関与する、特異性の高いアスパルチルプロテアーゼです。肝臓で産生されるアンジオテンシノーゲンを切断し、アンジオテンシン I を生成させます。アンジオテンシン I は、アンジオテンシン変換酵素によりアンジオテンシン II に変換されます。アンジオテンシン II は、血管を収縮させ、また腎臓においてナトリウム再吸収を増加させることで、血圧上昇をもたらすことが示されています。レニン前駆体は、20アミノ酸残基(プレセグメント)および46アミノ酸残基(プロセグメント)を結合した、406アミノ酸からなる一次構造をもちます。成熟型レニンは340アミノ酸からなり、推定分子量は 〜37 kDa です。
仕様
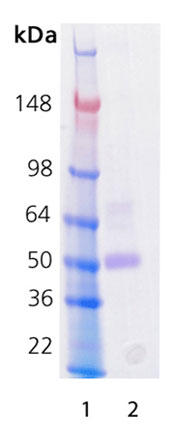
| 分子量 | 〜52kDa(推定分子量 38.3 kDa) |
| 由来 | HEK 細胞で産生。成熟型レニン(アミノ酸 67-406)のN末端に FLAG®-タグを融合。 活性型で、プロレニンペプチド(アミノ酸 1-66) を含まない。 |
| 濃度 | 0.1 mg/mL(推奨の方法で再構成した場合) |
| 組成・性状 | 凍結乾燥 25mM MES, 150mM NaCl |
使用例
- Catalytic Properties of Intramembrane Aspartyl Protease Substrate Hydrolysis Evaluated Using a FRET Peptide Cleavage Assay: S.H. Naing; ACS Chem. Biol. 10, 2166 (2015),
- Cloning and sequence analysis of cDNA for human renin precursor: T. Imai, et al.; PNAS 80, 7405 (1983), Abstract;

- Renin-angiotensin system: biochemistry and mechanisms of action: M.J. Peach; Physiol. Rev. 57, 313 (1977), Abstract;

レニン(ヒトリコンビナント/活性型)
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Renin (active), Human |
ENZ | ENZ-PRT193-0010 | 10 UG |
¥45,000 |
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について
- 「レニン(ヒトリコンビナント/活性型)」は、下記のカテゴリーに属しています。
-
- カテゴリから探す > 生理活性物質 > その他の生理活性物質
- カテゴリから探す > シグナル伝達 > メタボリックシンドローム > 高血圧、高血糖、高脂血症
- 研究分野から探す > 代謝 > 腎機能測定























 このページを印刷する
このページを印刷する
![FRETペプチド基質[Arg-Glu(EDANS)-Ile-His-Pro-Phe-His-Pro-Phe-His-Leu-Val-Ile-His-Thr-Lys (DARBCYL)-Arg]を用いたレニン活性の定量](https://www.cosmobio.co.jp/product/uploads/detail_images/ENZ_ENZPRT1930010_2.jpg)








 中身を見る
中身を見る 中身を見る
中身を見る 中身を見る
中身を見る
 中身を見る
中身を見る