 |
五十里 彰 先生 岐阜薬科大学 生命薬学大講座 生化学研究室 |
Rhodamine Phalloidin を用いた細胞遊走の検出
ユーザーレポート
Product
- Rhodamine Phalloidin (品番:PHDR1)
メーカー:Cytoskeleton, Inc. メーカー略号:CYT
■ Rhodamine Phalloidin(ローダミンファロイジン)
細胞内におけるFアクチンの分布を蛍光イメージングにより観察できます
- 固定細胞におけるF-アクチンの染色
- In vitro におけるアクチンフィラメントの固定化/可視化
製品使用文献
Shimobaba S, Taga S, Akizuki R, Hichino A, Endo S, Matsunaga T, Watanabe R, Yamaguchi M, Yamazaki Y, Sugatani J, and Ikari A.Claudin-18 inhibits cell proliferation and motility mediated by inhibition of phosphorylation of PDK1 and Akt in human lung adenocarcinoma A549 cells. Biochim Biophys Acta. 2016 Jun;1863(6 Pt A):1170-8.
実験内容
私たちの体は約60兆個の細胞からなっていると考えられていますが、もともとは母胎の中で受精した1個の細胞が分裂したものです。日々、傷つき古くなった細胞が死ぬとともに、新しい細胞が生まれることにより、全体のバランスがとられています。腸管、腎臓、肺などを構成する上皮細胞は、日々脱落と再生を繰り返しています。この脱落と再生が激しい組織では、がんのリスクが高いと考えられています。
がん細胞(悪性腫瘍)は自立性の増殖能を有するだけでなく、遊走能を獲得して他の臓器へ転移、浸潤します。リンパ節や血管へ転移すると、全身にがん細胞が広がってしまいます。また、脳や骨などに転移すると、日常生活に大きな支障をきたします。そのため、がん細胞の転移や浸潤を抑制する、新しい治療薬の開発が切望されます。
細胞遊走能の評価法には創傷治癒アッセイ(スクラッチアッセイ)やトランスウェルアッセイ(ボイデンチャンバーアッセイ)などがあります。創傷治癒アッセイでは均一な引っ掻き傷をつける必要があるため、技術と経験が要求されますが、簡便に遊走能を評価することができます。細胞培養ができるようになった学生ならば、数回練習すれば再現性のある結果がとれています。近年では、インサートを用いた手法(CytoSelect™ 24-well Wound Healing Assay、Cell Biolabs社 CBA-120)や生体適合性ゲルを用いた手法(Cell migration BioGel assay、Enzo Life Sciences社 ENZ-KIT109-0001)なども利用されています。
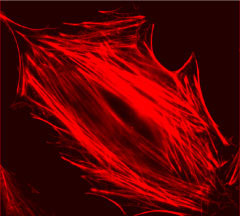
アクチン細胞骨格は細胞膜直下に豊富に存在します。細胞が移動する際には、細胞の先端部にアクチン繊維からなるラメリポディアやフィロポディアと呼ばれる突起が形成され、細胞外基質との接着を変化させることによって前方へ進みます。コスモバイオ社から販売されている Rhodamine Phalloidin(PHDR1、Cytoskeleton社)で染色した細胞の先端部を観察すると(プロトコール参照)、アクチン線維が先端部に向かって伸びている様子がわかります(図1)。蛍光強度が強く、かつ退色しにくいようで、研究を始めたばかりの学生でも、きれいなサンプルが調製できました。細胞を LY-294002(PI3K阻害剤)やサイトカラシンD(アクチン重合阻害剤)で処理すると、先端部のアクチン線維が少なくなり、ラメリポディアやフィロポディアの突起も減少しました。また、Rhodamine Phalloidin は細胞の境界面をコントラスト良く染色するため、LY-294002 やサイトカラシンDによる遊走能の阻害効果も評価しやすかったです(図2)。Rhodamine Phalloidin を用いたアクチン細胞骨格の染色により、ラメリポディアやフィロポディアなどの形態の変化を観察することができ、遊走能の制御機構やがん細胞の転移・浸潤阻害薬の開発研究において有用であると思われます。
プロトコール
創傷治癒アッセイのプロトコール
- 予めカバーガラスをコラーゲンなどの細胞外マトリックスでコーティングする
- 細胞をコンフルエントの状態になるようにカバーガラス上に培養する
- イエローチップで引っ掻き傷をつける
- 血清濃度を低下させた培地(0.1〜0.5% FBS)に交換する
- 経時的に明視野で細胞画像を撮影する
Rhodamine Phalloidin 染色のプロトコール
- 創傷治癒アッセイの指定時間に、細胞をパラホルムアルデヒドで固定する
- PBSで3回洗浄する
- 細胞を 0.1% Triton X-100/PBS で10分間処理し、膜透過性を増大させる
- 0.1mg/mL の Rhodamine Phalloidin を添加し、室温で1時間インキュベートする
- PBSで3回洗浄する
- カバーガラスをスライドガラスにのせ、蛍光顕微鏡で細胞画像を撮影する























 このページを印刷する
このページを印刷する
