|
高橋 忠伸 先生 静岡県立大学 薬学部 生化学分野 |
レクチンを用いたシアロ糖鎖末端構造の検出
ユーザーレポート
Products
- Lectin from Sambucus sieboldiana/SSA-Biotin(J- オイルミルズ社 品番 : J218)
- Lectin from Maackia amurensis/MAM-Biotin(J- オイルミルズ社 品番 : J210)
メーカー:株式会社J-オイルミルズ
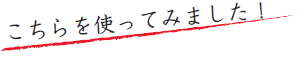
■ シアル酸を認識するレクチン MAM、SSA、WGA
| レクチン | 認識する主な糖鎖 |
|---|---|
| MAM | Sia α2-3Gal β 1-4GlcNAc β 1- |
| SSA | Sia α2-6Gal β 1-4GlcNAc β 1- |
| Sia α2-6GalNAc | |
| WGA | シアル酸が数個クラスター状に存在する糖鎖 例:トリ、テトラシアロN型複合型糖鎖、クラスター状のムチン型糖鎖 |
実験内容
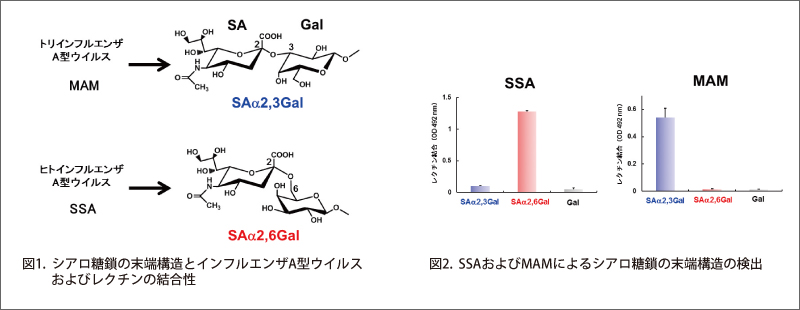
レクチンは糖鎖構造を認識して結合する。そのため、検出したい糖鎖構造に対応するレクチンがあれば、糖鎖の発現分布などを簡便に染色することができる。ただし、検出したい糖鎖構造以外の構造を認識することもあるので注意が必要である。私の研究分野である糖鎖ウイルス学では、糖鎖末端に存在するシアル酸に結合するレクチンがよく利用される。シアル酸を持つ糖鎖(シアロ糖鎖)は、インフルエンザウイルスが宿主細胞に感染する際の受容体として利用している。インフルエンザA型ウイルスは、シアル酸(SA)とその直下のガラクトース(Gal)の結合様式を見分けることができる。本解説ではSAは、SAの主要分子種のN-アセチルノイラミン酸のことを指す。インフルエンザA型ウイルスが結合するシアロ糖鎖構造の末端には、SAの炭素の位置番号2位とGalの炭素の位置番号3位との結合(SAα2,3Gal)、あるいはGalの炭素の位置番号6位との結合(SAα2,6Gal)がある(図1)。ニワトリの気管に分布しているSAα2,3Galには、トリインフルエンザA型ウイルスが強く結合する。一方、ヒト上気道に発現しているSAα2,6Galには、ヒトインフルエンザA型ウイルスが強く結合する。このようなウイルスの結合性の違いは、トリインフルエンザA型ウイルスが容易にヒトへ感染伝播できないと言った宿主特異性のバリアーとされる。トリインフルエンザA型ウイルスの受容体結合性のSAα2,3GalからSAα2,6Galへの変化は、トリからヒトへ宿主を越えた感染伝播を引き起こす要因の一つと考えられている。ウイルスが結合するシアロ糖鎖末端のSAα2,3Galの検出にイヌエンジュ Maackia amurensis レクチン(MAM)、SAα2,6Galの検出にニホンニワトコ Sambucus sieboldiana レクチン(SSA) が用いられる(図1)。
インフルエンザA型ウイルスの受容体結合性を測定する方法として、SAα2,3GalあるいはSAα2,6Galを末端構造とする糖鎖をELISAプレートに固相化する方法がある。ウイルスを反応後、糖鎖に結合したウイルス量を測定することで受容体結合性を比較する。γ-ポリグルタミン酸ポリマーにSAα2,3あるいはα2,6Galβ1,4GlcNAc(GlcNAcはN-アセチルグルコサミン)の糖鎖構造を付加した糖鎖ポリマーは、インフルエンザA型ウイルスに強力な結合性を示す。この糖鎖ポリマーをELISAプレートに固相化することで、ウイルスの受容体結合測定法の高感度化が図れる。
糖鎖ポリマーがプレートに固相化されたことを確認するため、レクチンによる糖鎖末端構造の検出を試みた。エタ ノールに希釈したSAα2,3Gal、SAα2,6Gal、およびSAを持たない糖鎖ポリマー(50 ng / ウェル)を96ウェルマイクロプレート(Costar Universal-BIND)に加え4°C、2時間減圧下で蒸発乾固し、1分間のUV照射(256 nm)にて固相化した。PBSで5回洗浄後、1%脱脂BSA-PBS懸濁液(300 μL / ウェル)で4°C、一晩ブロッキングした。PBSで5回洗浄後、ビオチン標識SSA(J-オイルミルズ社 品番 : J218)またはビオチン標識MAM(J-オイルミルズ社 品番 : J210)を100 μL / ウェル(5 μg / mL)で室温、2時間反応させた。PBSで5回洗浄後、HRP標識ストレプトアビジン(130 μL / ウェル)で室温、1時間反応させた。PBSで5回洗浄し、o-フェニレンジアミン塩酸塩とH2O2を添加した100 mMクエン酸-リン酸緩衝液(100 μL / ウェル)で室温、10分間発色させた。1N硫酸(100 μL / ウェル)で発色反応を停止し、492 / 630 nmの吸光度を測定した。SSAはSAα2,6Gal糖鎖ポリマーに、MAMはSAα2,3Gal糖鎖ポリマーにそれぞれ強く結合し、各糖鎖ポリマーがプレートに固相化されていることが確認できた(図2)。
今回の実験は均一化された糖鎖構造を使用していることから、レクチンにより糖鎖構造の違いを明確に検出できた。しかし、実際の組織や細胞における多様な構造の糖鎖発現をレクチン染色のみで明快に解釈しようとすることは危険である。MAMはO型糖鎖に反応しないこと、SSAはO型糖鎖に反応し、さらにSAα2,6GalNAc(GalNAcはN-アセチルガラクトサミン)にも反応すること、あるいはSAの分子種の違いによるレクチン反応性の差など、レクチンの糖鎖結合特性を文献等でよく理解した上で使用する必要が あるものと思われる。























 このページを印刷する
このページを印刷する