若月 修二 先生
Shuji Wakatsuki
国立研究開発法人 国立精神・神経医療研究センター 神経研究所
疾病研究第5部 室長
若月 修二 先生
Shuji Wakatsuki
国立研究開発法人 国立精神・神経医療研究センター 神経研究所
疾病研究第5部 室長

| 品名 | 品番 | 包装 |
|---|---|---|
| Ubiquitin (human), (recombinant) (His-tag) | BML-UW8610-0001 | 1 mg |
| Ubiquitin activating enzyme E1 (human), (recombinant) (His-tag) | BML-UW9410-0050 | 50 µg |
| UbcH5c (human), (recombinant) (His-tag) | BML-UW9070-0100 | 100 µg |
メーカー:Enzo Life Sciences,Inc. メーカー略号:ENZ
| ユビキチン、ユビキチン様タンパク質 その他派生品 | ターゲット/基質タンパク質 |
|---|---|
| Ubiquitin SUMO NEDD8 ISG15 FAT10 Ubiquitin & Ubl Mutants Ubiquitin & Ubl Terminal and Side Chain Derivatives Ubiquitin & Ubl Chains |
Activating Enzymes NF-κB and IKKα p53 SUMOylation Substrates NEDDylation Substrates |
| ユビキチン&ユビキチン様タンパク質 抗体 | 検出&単離キット |
| Ubiquitin-reactive Antibodies K63-linkage-specific Ubiquitin-reactive Antibody Blocking Peptides for Ubl-reactive Antibodies |
Ubiquitin & Ubl Agarose Conjugates Ubiquitin-binding Domains Detection, Isolation and Modification Kits |
| ユビキチン レムナント プロファイリング | プロテアソーム&関連商品 |
| Activating Enzymes Conjugating Enzymes Ligases Deconjugating Enzymes |
11S Activator 19S Regulator Proteasome 20S Complex Proteasome Inhibitors Proteasome Substrates Proteasome 26S Proteins & Kits COP9 Signalosome (CSN) Tripeptidyl Peptidase (TPPII) Autophagy |
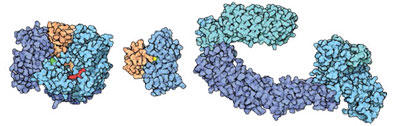
真核細胞には進化的に保存された蛋白分解機構が存在し、細胞の恒常性を維持、監視している。特にユビキチン・プロテアソーム系(UPS)による蛋白分解は迅速かつ、明確な基質特異性をもつ反応であり、標的となる蛋白質分子を選択的に分解することで、それらのはたらきを質的、量的に変動させ、増殖や分化などさまざまな細胞プロセスを調節している。標的となる蛋白質分子は、ユビキチン活性化酵素(E1)、ユビキチン結合酵素(E2)、そしてユビキチンリガーゼ(E3)による一連の酵素反応によりユビキチン分子を付加される(図1)。ヒトゲノム中にはおよそ 600 のE3が存在するが、どのE3もユビキチンと結合したE2と同時に基質蛋白質と特異的に結合することから、UPSの基質特異性はE3が規定すると考えることもできる。しかしながら、ひとつの蛋白質分子を標的とするE3が複数存在する例も知られており、あるE3が真に特定の蛋白質分子をユビキチン化の標的とするのか示すためには、リコンビナント蛋白質を用いた試験管内ユビキチン化反応により、ユビキチンリガーゼ活性を確認する必要がある。
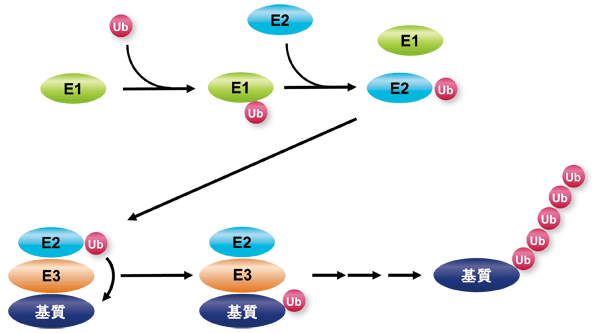
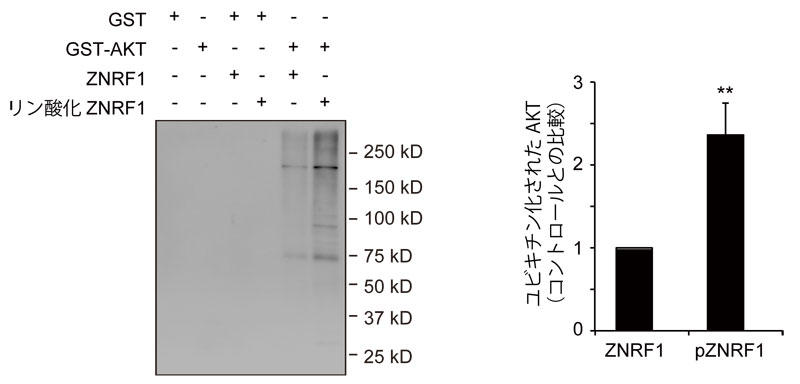
筆者のグループは、アルツハイマー病やパーキンソン病など、神経難病に共通する神経変性の分子機構の解明を目指して研究を行っている。これらの神経難病では、ニューロンが徐々に死んで失われることで脳のはたらきが低下するが、ニューロンの死に先立って軸索が失われる「軸索変性(軸索が壊れること)」が観察される。軸索は神経細胞に特有の突起構造で、神経ネットワークのケーブルのようなはたらきを担う。筆者らは、軸索の骨組みである微小管に着目した研究を行い、ダメージを受けたニューロンでは微小管を積極的に壊す反応が活発になり、軸索を変性させることを世界に先駆けて報告した。この反応経路では、蛋白質キナーゼAKTがE3であるZNRF1 (zinc and ring finger 1) を介してユビキチン化されてプロテアソーム依存的に分解され、この反応がきっかけとなって軸索変性が促進された(文献1)。興味深いことに、ZNRF1は普段は不活性であるが、ダメージを受けたニューロンではEGF受容体によりリン酸化され、AKTに対するユビキチンリガーゼ活性が高まることが、初代培養ニューロンを用いた実験結果により示唆された。ZNRF1のユビキチンリガーゼ活性がリン酸化依存的に亢進することを示すため、試験管内リン酸化反応とユビキチン化反応を組合せた実験を行った(図2)。ATPを含む緩衝液中で活性化型EGF受容体によりZNRF1をリン酸化させ、リン酸化の有無によるユビキチンリガーゼ活性の変化を試験管内ユビキチン化反応により検討したところ、リン酸化によりZNRF1のユビキチンリガーゼ活性が亢進することが示された(文献2)。
今回、ZNRF1とAKTは大腸菌で生産し、精製して実験に用いた。活性化型EGF受容体は GenWay biotech社より、ユビキチン、E1(Ube1)、ならびにE2(UbcH5c)は Enzo life sciences社より購入した。試験管内ユビキチン化反応を成功させるコツはケース・バイ・ケースではあるが、Zn2+-finger型 E3の場合、筆者の経験ではE3を精製するときに、1)精製からユビキチン化反応までの全ステップに亜鉛イオンを加える。2)添加するプロテアーゼ阻害剤に含まれるEDTA などのキレート剤を除く。また、ユビキチン化反応のときに、3)pH を弱アルカリ性(8.5 くらいまで)にする。4)還元剤としてDTTを加える。これらのオプションを試すことで、反応が劇的に改善するケースもある。また、大腸菌ではなく、培養細胞から免疫沈降などにより粗精製したE3を使用することも改善につながるケースがある。当然のことながら、反応系の酵素が正しくはたらいてくれなければ実験は成立しないので、ユビキチン、E1やE2など、市販の酵素を使用する場合には、信頼できる製造元から購入することが肝要である。例えば、反応が安定しない場合には、遠まわりのようではあるが、既存のユビキチンリガーゼを用いて、使用しているユビキチン、E1、ならびにE2が確実に活性を有していることを確認する必要もある。
© COSMO BIO