はじめに 〜細胞培養とは〜
細胞とは、生命の基礎単位ですが、生物学においては非常に有用な研究ツールでもあります。細胞は、生理学的プロセスの理解や医学的治療で利用する毒物、あるいは治療化合物のスクリーニングにおいて不可欠なモデルシステムです。さらに、機能的酵素、増殖因子やワクチンの産生をはじめとした多種・多様な目的で、細胞は主要な役割を担っています。このような目的を達成するためには、まず、細胞をその由来生物から引き離した環境下で培養する必要があり、これが細胞培養過程です。つまり、細胞培養には、多細胞生物の細胞をその由来生物の外で、的確な条件下で細胞を維持することが必要となるのです。
細胞培養の重要性
ワクチン研究
培養細胞は、細胞生物学者、生体材料研究者、臨床医をはじめとした多くの研究者に加え、規制当局にも使用されるように、広範な用途があります(2)。なかでも、細胞培養の最も重要な用途のひとつとして、ワクチンの研究や生産があげられます。培養細胞内で大量のウイルスを生育できることからポリオワクチンが生成され、今日に至っても数々の疾患に対するワクチンの大量産生には細胞培養技術が使われています。1930年代から40年代初頭には、研究者はポリオウイルスの生育に生きている動物を使用することが必須でしたが、細胞培養技術の開発・改良により、ウイルス産生を良好に制御しつつ、大量産生することが可能になりました (3)。これにより、研究者はさらに詳細な研究をすることができ、結果としてワクチンやさまざまな治療が開発されています。
タンパク質治療
細胞株の重要な利用方法として、哺乳動物細胞内での複数種のタンパク質発現が挙げられます(2)。当初は、E.coliがタンパク質産生に使用される主要な生物でしたが、より適切に折り畳まれ、より適切な翻訳後修飾を受けたタンパク質の産生が求められるようになり、真核生物を利用したタンパク質発現に焦点が当てられるようになりました(4)。そして、1970年代から80年代には、インターフェロンや抗体といったタンパク質が、細胞培養によって産生することが可能となりました。さまざまなサイトカインや増殖因子が培養によって取得でき、これらのタンパク質の構造や活性を確認することが、生体におけるこれらの役割の理解につながります。別々の細胞や条件下で産生したタンパク質を観察することだけでも、タンパク質環境がその活性にどのように影響を与えるか判定するのに役立ちます。
がん研究
がんは、世界中で死亡の第一原因のひとつであり、その処置や治療を探索するがん研究には多額の研究費が費やされています。放射線、化学物質、およびウイルスといった手法を用いて正常細胞をがん細胞へと転換させるうえで細胞培養は非常に重要な役割を果たします(5)。これらのがん化細胞は、がん研究のより詳細な研究や、新規治療候補の試験に使用されます。
細胞培養の分類 〜 初代細胞 対 株化細胞 〜
研究室で主に使用される2つの細胞形態は、初代(培養)細胞と株化細胞です。
初代細胞は有限細胞とも呼ばれ、生体組織から直接調製されたものです(6)。適切な条件下で生育すると、初代細胞は成長・増殖するものの、ヘイフリック限界として知られる有限回数までしか分裂することができません(7)。ヘイフリック限界は、細胞DNA末端のテロメア長に関係します。細胞が各細胞周期を経ると、各DNA複製後にテロメアの小区域が失われ、この過程がいずれ老化段階へと導き、細胞分裂することができなくなります。
これに対し、株化細胞では、正常な細胞がもつ細胞周期の制約を回避することができ、無限に成長・増殖するため、長期研究に非常に有用です(8)。初代細胞はドナーの生体組織より直接入手するのに対し、株化細胞はがん組織由来か、あるいは、がん遺伝子のウイルス粒子や化学的手法により、初代細胞を形質転換して構築したものです。
細胞周期と不死化
初代細胞の長所は、その細胞が由来する組織の特徴をほぼ維持していることですが、培養・維持が難しく、ロット間での変動もああります。一方、不死化細胞はこの問題点を回避し、研究資材の安定供給を可能にします。
細胞の不死化を理解するためには、まず哺乳動物細胞周期を理解することが重要になります。哺乳動物細胞周期は5期からなり、3つのギャップ期であるG0, G1 とG2、合成期および有糸分裂期があります(図.1) (9)。これらの5期は、ギャップ期と合成期からなる間期と、有糸分裂期の2つの主要部分にわけられます(9)。細胞がG0にある場合、静止期にあり、分裂の準備はしません。増殖因子といった分裂促進因子の結合により細胞がG0よりG1に入り、分裂の準備を始めます。分裂促進因子は、細胞の有糸分裂を誘導します(10)。G1, S, および G2では、細胞は有糸分裂などの分裂に備えるためRNA、タンパク質、およびDNA複製 / 産生をします(9)。
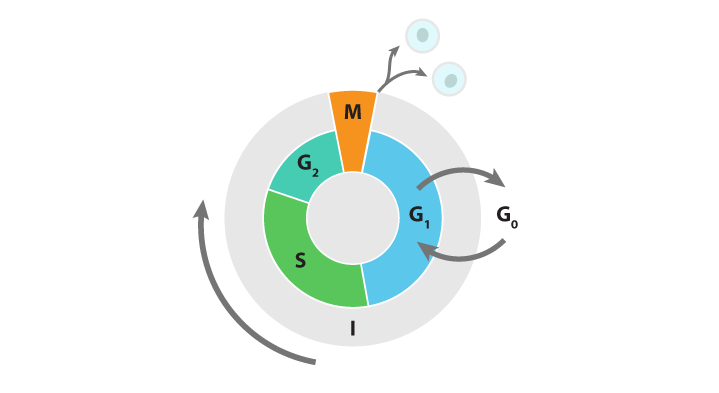
図.1 細胞周期
各々の細胞周期にはいくつかのチェックポイントがあり、これを通過した場合に限って細胞が次の段階に移行することができます。最初のチェックポイントはG1の最後にあります。制限点としても知られ、細胞が細胞分裂へ移行するよう許可する役割を担います。2番目のチェックポイントはS期にあり、複製DNAの品質および、DNA修復機構を活性化する必要性を確定します。3番目のチェックポイントはG2の後にあり、この目的もDNAが完全に複製され、損傷がないことを確認することです。最後に、有糸分裂期にいくつかのチェックポイントがあり、細胞周期終結に向けて細胞質分裂をはじめ細胞が適切なポジションにあることを確たるものとします (9)。
さまざまな分子が細胞周期の時期を制御する役割を担っており、サイクリン、サイクリン依存性キナーゼ(Cdks)、およびCdk阻害剤などがあります(9)。一般的に、サイクリンはCdksに結合して複合体を形成し、これが細胞をある周期の過程から次のステップへと移行させます(9)。サイクリンは、細胞周期を通じて産生と破壊をくりかえし、そのレベルによって細胞周期のどの段階にいるのかを判断することが可能です(9)。Cdk阻害剤は、その名の通りこれらサイクリン-Cdk複合体と結合することができ、次の周期段階への起動を妨げます(9)。
他にも、腫瘍抑制タンパク質p53が細胞周期と細胞不死化において重要であることが知られています。p53はG1 と G2の後のチェックポイントで役割を担っています。DNA損傷がある場合には、Cdk阻害剤p21の転写を誘導し、これによりG1サイクリン-Cdk複合体の活性化を防ぎます(9)。p53の抑制により、細胞周期が進行し、増殖が継続され、その結果、細胞が不死化します。細胞を不死化させる方法はいくつかありますが、例えばE6とE7がん遺伝子、あるいはE1aとE1bタンパク質を導入する方法が知られています(10)(12)。
腫瘍抑制因子p53とpRbは、前述の通りG1 と G2 チェックポイントにおける細胞周期の進行阻害において非常に重要な役割を担いますが、ヒトパピローマウイルス由来のE6とE7がん遺伝子はこれらの腫瘍抑制因子を崩壊させます(13)(14)。E6はまた、DNA末端のテロメア崩壊を防ぐテロメラーゼをコードするhTERT遺伝子発現を誘導します(14)。いくつかのアデノウイルス由来のE1タンパク質もまたp53に結合することができ、E6やE7がん遺伝子に類似した効果をもつことも知られています(15)。
細胞を不死化する方法は他にも多々あります。その1つは、テロメラーゼを触媒として細胞に導入し、テロメアの短縮を防ぐ方法です (6)(10)(16)。テロメアは時間の経過とともに短くなっていきますが、この短縮こそが老化や細胞死を誘導すると考えられています(16)。他に、細胞周期の主要な制御因子であるp53やpRbを不活性化することで細胞周期チェックポイントを変更する方法もあります(図2) (10)。
全ての不死化細胞が初代細胞と同一の特徴を維持しているわけではないため、注意が必要です。新しく樹立した不死化細胞では、その特性を確認する実験を行い、目的の実験計画においてその細胞が有用であるかの確認を要します。
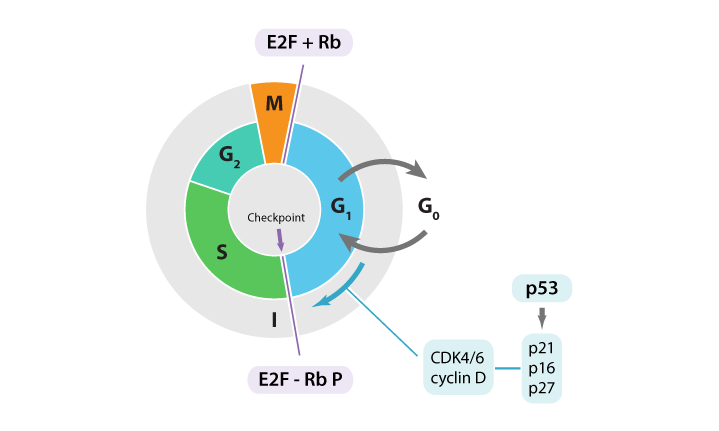
図.2 細胞周期におけるp53とpRb
- 細胞の不死化に関するより詳細な情報は、細胞不死化ガイドラインをご参照ください。
- 各種の不死化細胞もご提供しております。
細胞増殖の環境・条件
細胞培養には、単層(接着培養など)または培養培地内での遊離浮遊といった2つの主要な成長条件があります(17)。接着細胞は、細胞外マトリックス(ECM)を利用して培養容器に接着します。ECM(間質)は、固定・包埋された結合組織由来であることが一般的です (17)。浮遊細胞は、液体培地に懸濁した状態で成長することができます。浮遊細胞は、通常、リンパ球のような血液システム由来の細胞です(17)。
細胞培養培地
細胞株が異なる場合には、一般的にその細胞株に合わせた特定の培地が必要です (7)。全ての培地は、アミノ酸、無機塩、およびビタミンを含みます(7)。ウシ胎児血清(FBS:Fetal Bovine Serum)は、生命維持に必要な巨大分子、増殖因子、および免疫分子を細胞に供与するため、培養開始前に培地に添加することが通常です(7)。ペニシリンやストレプトマイシンといった抗生物質は、細菌や真菌、(ごく稀な)マイコプラズマによる細胞培養汚染を防ぐ目的で添加します(7)。現在、数々の培地が市販されていますが、ごく一般的な培地としては、DMEM、RPMI、およびF12などがあります。
- マイコプラズマ汚染への具体的な対処については、特集:マイコプラズマ対策のページをご参照ください。
培地のpH緩衝
培養培地のpHが細胞に適さないと、細胞自身にとって有害な作用となる場合があるため、培地中のpHを管理することも重要です(18)。適切なpHが確実に維持されるよう、炭酸水素ナトリウムなどの緩衝剤(液)を培地に添加します(18)。炭酸水素ナトリウムはCO2ガスにより培地中のpHを7.2〜7.4に維持しますが、これはほとんどの細胞株で理想的な条件です(18)。炭酸水素緩衝システムを用いた培養には、5〜10% のCO2が必須ですが、CO2インキュベーター(細胞培養器)を使用することで、この条件下で培養できます。あるいは、HEPESのような双性イオンを利用する化学緩衝システムを使用することもあります。CO2インキュベーター(細胞培養器)を使用する場合には、HEPES緩衝液は必要ありません。培地にはフェノールレッドのようなpH指示薬が含まれており、培地に特定の色を呈することで、研究者が培養培地のおおよそのpHを簡単に判断できる手助けをします(18)。
無血清培地
上述の通り、培地には複数の構成物が含まれますが、ウシ胎児血清(FBS:Fetal Bovine Serum)のような生体由来の試薬を添加する場合、その正確な組成を特定することは困難です。例えば、ウシ海綿状脳症(BSE)に罹患したウシから血清を採取した場合には、FBSにプリオンが含まれる可能性もあります(19)。さらに、FBSはロットごとに組成が若干異なるため、この違いが細胞培養にさまざまな影響を及ぼす可能性があります。こういった種々の問題を解決するために無血清培地が開発されてきました。無血清培地であれは、構成物の組成はすべてあらかじめわかっており、かつ適切な濃度で添加されています。構成物には、増殖因子やリポタンパク質なども含まれています。(20)
温度
ある細胞は37°Cでの成育を好み、別の細胞では33°Cの条件を好むといったように、至適な外部環境条件は細胞によって異なります。外部環境条件は細胞の増殖や分化に大きく影響するため、厳密に管理する必要があります(22)。ほとんどの哺乳動物細胞は37°Cが最適な生育条件ですが、変温動物由来細胞はより広範な温度域をもつ傾向があります(例:15°C〜26°C)。
培養容器・器材
細胞培養に使用する容器や器材は、サイズ、形状、コーティングや蓋のあり/なしなど多種多様な製品が市販されています。サイズは、小さなものでは96ウェルプレートから大きなものではT175フラスコまであります(図3)。コーティングにも、さまざまな種類がありますが、代表的なものとしてはコラーゲン、ゼラチン、フィブロネクチンなどがあります。これらのコーティング剤は、種々の細部外マトリックスであり、細胞がもともと存在していた天然の環境条件を模倣するために使用され、細胞の成長に役立ちます (23)。実験要件に応じて細胞の培養器材は変更することができ、ローラーボトル、スピン培養また細胞培養チャンバーなどを利用することで実験をスケールアップすることもできます。
図.3 一般的な細胞培養容器・器材
細胞培養の設備
細胞を培養する際には、無菌手技が非常に重要となります。マイコプラズマのような細菌類や真菌の感染は、これらを同定したり除去したりする必要が生じ、大きな問題になります(7)。そのため、全ての細胞培養作業は、無菌環境下で適切な無菌手技を行うことが必須であり、いくつかの検討事項があります。
空気処理システム -クリーンベンチ・安全キャビネット・クリーンルーム-
細胞培養作業を行う際はいつも、クリーンベンチ・安全キャビネットなどの層流機器/フードを使用し、使用前後は70%エタノールを全体に噴霧します(7)。層流機器/フードは、定常かつ清浄な気流を保ち、培養環境への外部汚染を防止します(図.4)。これらの機器は外部環境から空気を取り入れ、HEPAフィルターシステムを通し、作業台表面を横切るように清浄な空気を排出して無菌作業環境を作ります(24)。多くの層流機器/フードはUV光も設置されており、使用後にUV光を点灯することで残余している病原体を殺傷し、内部を滅菌します。培地やチューブなどをフード内に入れる場合は、70%エタノールを噴霧します(7)。培地を使用するときには、蓋をあけている時間をできるだけ短時間にし、蓋の開放部分は作業面に向けて汚染物質の混入を防ぎます(7)。最後に、細胞培養作業を行う際には、常時手袋を着用し、定期的に70%エタノールで浄化します(7)。

図.4 層流機器/フード
生物学的汚染・コンタミネーション
培養液汚染は、細胞培養を行う上で最も頻繁に発生する問題です。生物汚染には、細菌、真菌、ウイルス、ならびに他の細胞株との交差汚染があり、時には、汚染源が明確である場合もあります。例えば、細菌汚染の場合、培地が懸濁し、顕微鏡下で観察すると、ヒト細胞より小さな何百万もの小さな粒子を確認できます。視覚的な確認ができない場合には、汚染物質の検出試験を行います。例えば、マイクロプラズマ汚染を検出する方法のひとつにPCRを用いる方法があります。培養中の細胞からDNAを抽出し、マイコプラズマ種ごとに特異的な配列のプライマーを使用してDNAをPCR反応にかけ、マイコプラズマDNAの存在を検出します(25)。マイコプラズマ検出用のキットはコスモ・バイオでも多数取り扱っています。特集:マイコプラズマ対策のページをご参照ください。
ウイルス感染は検出困難な汚染のひとつであり、培養液中のウイルス関連タンパク質の存在の検出には免疫染色やELISAアッセイを利用します。
細胞培養のマイコプラズマ汚染については、定期的に確認されることをお奨めしています。特集:マイコプラズマ対策のページをご参照ください。
交差汚染
細胞を培養する際、培養する細胞が異なる細胞株に汚染されていないことを確認することが非常に重要です。細胞株が過剰に成長し、元来の培養液中に誤って入りこんでしまった、他の成長の早い細胞と置換されることもあります。識別を誤った細胞株を使用し続けた結果、最悪の場合には偽の科学的結論を導く可能性もあります。
細胞株を立証する方法のひとつとして、短鎖縦列反復配列(STR)プロファイリングと呼ばれる手法があります。しかし、この方法はヒト細胞にしか適用できません(26)。ヒト細胞のDNAゲノムには、縦列反復配列多型(VNRT)ユニットとよばれる複数の反復配列をもつ高頻度可変領域があり(27)、これらの反復配列は、一般に1〜6塩基長で、反復数や実際の配列は各個人に特有です(27)。これらの配列をPCRで増幅し、各細胞株の標準プロファイル作製に利用します(27)。標準プロファイルは、各研究者が使用する細胞株の特性が正しいことを担保するうえで、使用細胞と比較するためのリファレンスとして使用されます (27)。
細胞培養技術
細胞培養にはさまざまな技術が利用されています。直接培養または細胞凍結に利用されるものや、細胞株の立証、細胞株間の交差汚染確認に使用されるものなど多岐にわたります。以下に、一般的な技術に関して要約します。
継代培養
培養液中で数日間培養すると、細胞は培養容器に対して過密状態となり細胞成長に有害となる可能性がありますが、長時間その状態で放置すると時間が経つにつれて栄養分を使い切り、細胞死を誘導します(7)。この細胞死を回避するために、細胞を他の容器にうつして継代培養をします。作業はシンプルで、もとの培養容器から細胞の一部を取り出し、新しい培地を入れた、新しい容器に移し替えるだけですが、これにより細胞が成長に必要な空間と栄養をより多く与えられることになります(7)。浮遊細胞の場合には、コニカルチューブにうつして遠心沈降させ、新しい培地に再懸濁します。この懸濁液を2つ以上に分け、新しい容器に添加します。接着細胞の場合には、まず容器から剥離する必要があります (7)。一般的なタンパク質分解酵素であるトリプシンは、培養容器への細胞接着を補助するタンパク質を分解するため、接着細胞の系代培養には、トリプシン処理とよばれる細胞解離工程が用いられています(図.5) (7)。
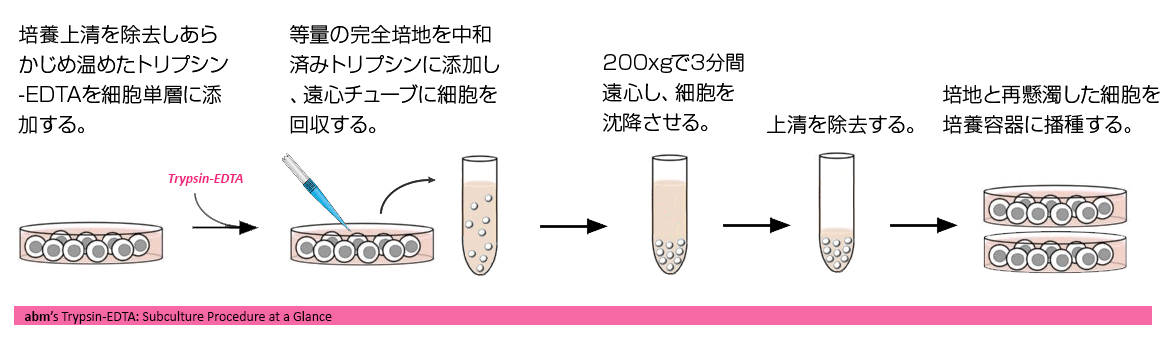
図.5 トリプシン処理および継代培養手順例
トリプシンより穏やかなディスパーゼやコラゲナーゼといった他の解離酵素を細胞の剥離に使用することもできます。トリプシンへの曝露時間が長くなりすぎると、細胞表面タンパク質を損傷し、その後の細胞接着や細胞機能に影響を及ぼすことがあります。したがって、ほとんどの細胞が培養容器から脱離した段階でトリプシンを希釈し不活性化する必要があります。通常、血清や二価陽イオンのカルシウムやマグネシウム(しばしば血清含有培地で形成)を添加して不活性化します。無血清条件で細胞を培養している場合、大豆トリプシン阻害剤を添加します。培養容器から細胞を遊離した後、コニカルチューブに細胞を移して遠心沈降し、新鮮培地を含む新しい容器に分割します(7)。
コスモ・バイオでは、お求めやすい価格のTrypsin-EDTAをご用意しています。接着細胞の剥離、組織の単一細胞懸濁への酵素的解離、ES細胞コロニーの解離などにご利用頂けます
播種密度
播種密度は、培養容器に添加する細胞数を示すもので、細胞を継代培養する際に注意すべき重要ポイントです。細胞株によっては高い播種密度を好むものもあれば、低密度において増殖できる細胞株もあり、また播種密度によってその細胞特性を変化させるものも存在します。例えば、培養液中の顆粒膜細胞は低密度でエストラジオールを分泌しますが、密度が上がるにつれプロゲステロンを多く分泌するようになります(28)。もし、細胞成長速度が早いことがわかっている場合や、細胞を長期培養する予定である場合、大きなサイズの培養容器を検討します。
増殖、集団倍加、および継代数
細胞の増殖期には、誘導期、対数期、静止期、および死滅期の4期があります(29)。誘導期では、細胞数は増加せず、細胞は増殖に向けた準備をします(29)。対数期では、細胞は増殖を開始し、時間経過とともに増殖が加速します。静止期では、栄養分の欠乏と毒性の代謝廃棄物の存在により、増殖率はプラトーに達し、一定速度を保つようになります(29)。最後に、細胞が死滅期に達すると、栄養分の欠乏、pH条件の変化、および毒性廃棄物の蓄積により死滅していきます(29)。細胞が新しい培地で対数期に入れるよう、誘導期に播種することが重要です(30)。細胞の凍結保存は、一般的に対数期に行います(25)。細胞培養の集団倍加とは、単純に細胞集団が二倍になるまでの時間です。その他、関連用語として「集団倍加レベル」がありますが、これは培養液中の細胞がin vitroで初めて成長したときから倍加するまでに要した総時間数のことです(31)。集団倍加レベルの算出に一般に使用される数式は以下です(32)。
Log10 (N/No) x 3.33
N:ある一定時間間隔後の培養容器中の細胞数
No :容器に最初に播種した細胞数
集団倍加と継代数は混同されたり、同じ意味あいのように考えられることもありますが、継代数は、培養が実際に継代培養された回数を示します(32)。集団倍加レベルと異なり、関与する細胞の特定数とは関連しません。単に、細胞がどれだけ古いか、様々なアッセイに対してどの程度適切であるか、といった一般的な指標を得ることができます (23)。
凍結保存
予期しない機器の故障や生物汚染などにより培養細胞が損失するといった事態に備え、保存用細胞を作製するような場合には、細胞を凍結保存します。細胞を貯蔵庫に保管することで、細胞培養を維持するや時間、労力、および資材を節約することもできます。最も重要であるのは、細胞を凍結することで有限細胞が死滅期に達することを防ぎ、長期培養中の遺伝子型不安定さによる表現型ドリフトが生ずる危険性を最小限に抑えられることです。
細胞凍結
細胞凍結の最初のステップは細胞沈殿を回収することですが、接着細胞か浮遊細胞かによって、手法が異なります。浮遊細胞の場合は、懸濁液をそのままコニカルチューブに移して遠心沈降させ、培地除去後に沈殿物を回収します。接着細胞の場合は、継代培養の場合と同様に、培地を除去してトリプシンを加えて細胞を容器表面から剥離します。トリプシンを中和するために血清含有培地を加え、チューブに入れた細胞を遠心沈降させ、沈殿を回収します(32)。沈殿物を回収後、浮遊細胞と接着細胞のいずれも、凍結保存用培地に細胞を再懸濁させます。細胞懸濁液の冷却がすすむと、細胞は水分を失い溶質濃度が上昇、さらに、氷晶が形成され細胞を損傷します。生存率低下を防ぐため、ジメチルスルホキシド(DMSO)やグリセロールといった凍結防止剤を凍結保存培地に添加し(34)、氷晶や浸透圧作用による細胞損傷から細胞を保護します(23)。細胞内氷晶から細胞を守る目的で、血清もこの培地に添加します(図6) (23)。
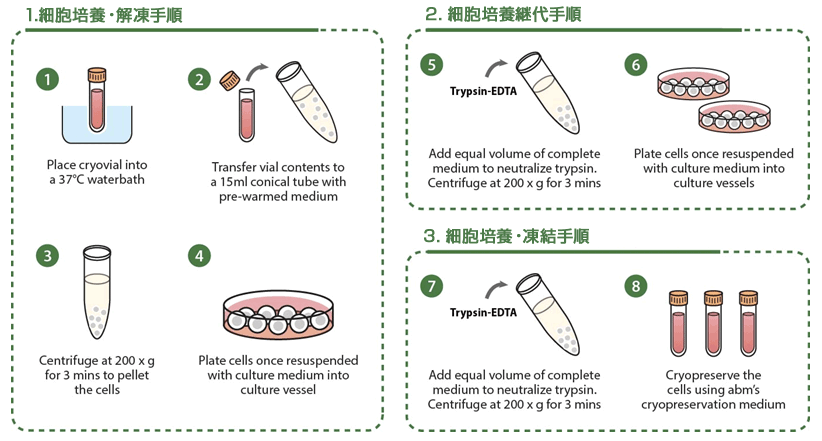
図.6 解凍、継代培養、および凍結手順の概略
解凍、継代培養、および凍結は、細胞が好ましい培地外に長い時間さらされると細胞損傷を引き起こすため、可能な限り迅速に行う。
- 凍結バイアルを37°Cの温浴につける。
- バイアルの中身を予め温めた培地を加えた15mlのコニカルチューブに入れる。
- 200xgで3分間遠心し、細胞を沈降させる。
- 細胞を培養培地に懸濁後、培養容器に入れる。
- 等量の完全培地を中和トリプシンに添加する。200xgで3分間遠心する。
- 細胞を培養培地に再懸濁後、培養容器に入れる。
- 等量の完全培地を中和トリプシンに添加する。200xgで3分間遠心する。
- 凍結保存培地を用いて細胞を凍結保存する。
細胞の保存には、冷却速度を-1°C/分に制御し、緩徐にすることが重要です。浸透圧により水分が細胞から徐々に抜けるため、細胞内での氷晶形成を最小限に抑えることができます。細胞の長期保存には、-130°C以下の温度が必要であり、特殊な冷凍庫、または液体窒素保存容器を使用します。凍結細胞は、何十年でも保存し、回復させることができます。
コスモ・バイオでは、標準型、無血清タイプなど、培養細胞凍結保存液 COS banker シリーズをご用意しています。iPS 細胞の凍結保存にもご使用いただけます。
細胞の解凍
細胞を解凍する場合には、細胞を保管してある凍結(クライオ)チューブを温かいお湯で急速に温め、培地と血清でリンスして毒性のあるDMSOを除去、適切な培地に懸濁後、培養容器に移し替えます。
用語集(35)(36)
- 接着細胞:培養容器に細胞外マトリックス(ECM)を利用して接着できる細胞
- 付着率:播種後、規定時間以内に、培養容器表面に実際に接着した細胞の割合
- 無菌操作:細胞、組織および臓器培養が、真菌、細菌、ウイルス、マイコプラズマ、および他の微生物による汚染を防ぐために用いられる手順。
- 細胞培養:in vitroにおいて細胞をその由来生物外で維持すること
- 細胞株:初代細胞株の最初の継代培養株のこと
- 株化細胞:初代培養または細胞株に由来するが、株化細胞は特有の特性やマーカーをもつ特定種の細胞。
- 凍結保存:細胞、組織、胚、または種を、通常-130°C以下の超低温で保存すること。
- 上皮細胞:連続したモザイク様シートを形成するために非常に近接し合って成長する細胞。他の細胞がお互いに接着すると、“上皮様細胞”と表現される。
- 線維芽細胞:紡錘や不規則な形をもつ細胞で、線維形成において重要な役割を担う。培養液中では、線維芽細胞と他の細胞種との区別が困難なことがあり、“線維芽細胞様細胞”という用語で表現される。
- 有限細胞培養:限られた数の継代培養のみが可能な細胞培養であり、これを超えると細胞増殖を止める。
- 不死化:継続的に増殖できるようになった細胞培養。
- 継代:細胞をひとつの培養容器から他のものへ移行させること。継代培養という用語は、複数の細胞培養容器に細胞を移す前に細胞をまず細分することを指す。継代数は、当該細胞株が何回継代培養されたかを明確に言及するもの。
- 初代培養:生物より直接採取した細胞、組織、または臓器をもとに開始した培養のこと。
- 浮遊培養:培養の種類のひとつであり、細胞は液体培地中で懸濁された状態で増幅する。























