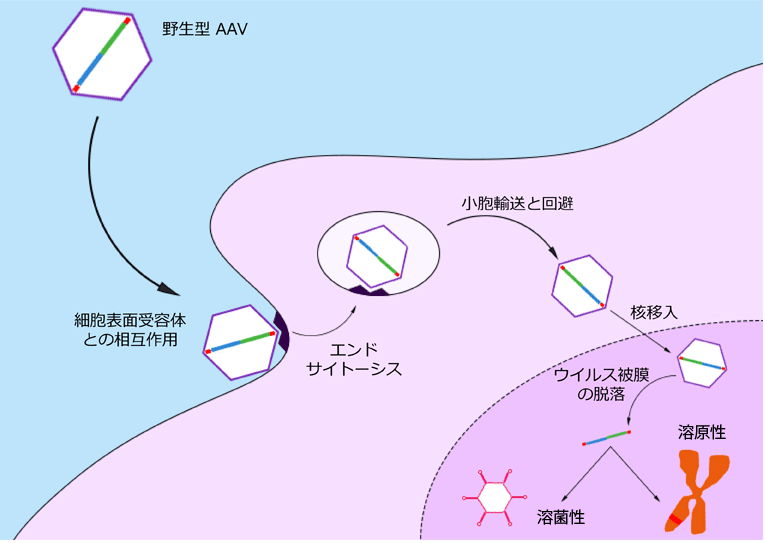
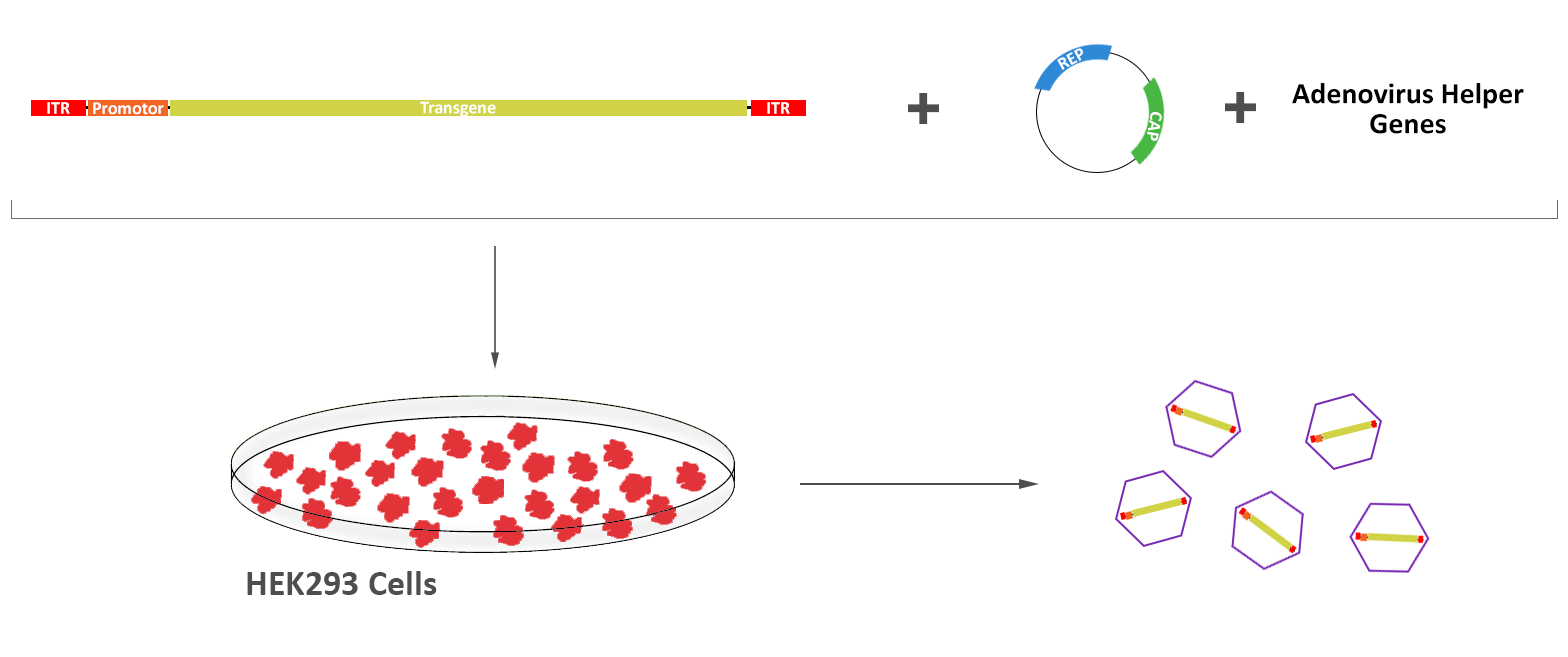
アデノ随伴ウイルス(AAV)は、1965年にピッツバーグ大学のDr. Bob Atchison(1)とNIHのDr. Wallace Rowe(2)によりアデノウイルス調製中の混入物として発見されました。その後の研究により、彼らはAAVウイルス粒子の複製がアデノウイルス存在下でのみ可能であることに気づき、その名称分類をパルボウイルス科のディペンドウイルス属としました(3)。
Cosmo Bio would like to acknowledge and thank the Applied Biological Materials Inc. for providing AAV information presented here.
- 「アデノ随伴ウイルス(AAV)ベクター&ウイルス粒子」
- アデノ随伴ウイルス(AAV)作製サービス
- ノックダウン用!レンチ/アデノ随伴ウイルスベクターとウイルス粒子
「格安siRNA発現クローンコレクション」