| 品番 | 品名 |
| 05-100-1 |
NutriStem® with Human Serum Albumin (Xeno Free) |
| 05-102-1 |
AF NutriStem® without Human Serum Albumin (Xeno Free) |
| 05-720-1 |
Bio-Pure HSA 10% Solution |
| 05-710-1 |
CryoStem ACF Freezing Media (optimized for Stem Cells) |
| 01-170-1 |
DMEM/F12 (HAM) 1:1 |
| 04-002-1 |
Certified FBS Qualified for hESC |
| 01-055-1 |
DMEM HG |
| 03-022-1 |
Alanyl-Glutamine |
| 03-042-1 |
Sodium Pyruvate |
| 01-944-1 |
0.1% Gelatin solution |
2.1 顕微鏡下での細胞観察
次の点に注意して顕微鏡下で細胞を観察します。
- ・フィーダー細胞の品質(90%以上が生存し、通常の線維芽細胞のと同様の形態と密度であるかどうか)
- ・通常の培地の色味と変わりはないか
・明らかなコンタミネーションがないか
- ・ヒトES/iPS細胞のコロニーの大きさ、品質、密度等
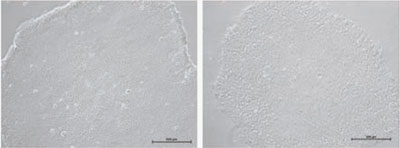
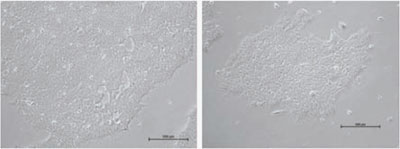
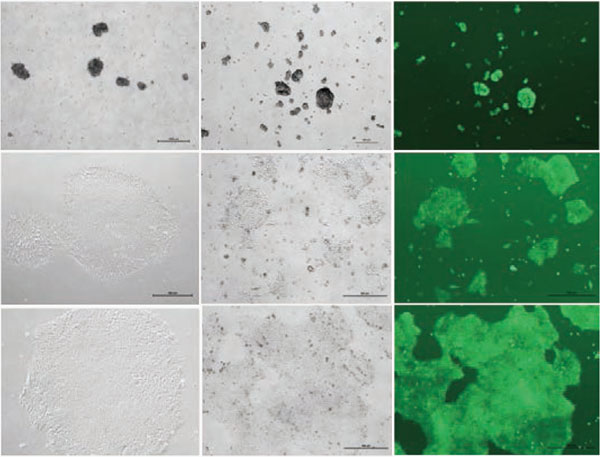
ヒトES/iPS細胞のコロニーは、Matrigel™上では大きく薄いコロニーとなりますが、フィーダー細胞上で培養すると比較的小さく密度が高い、丸い形状のコロニーを形成する傾向があります。自発的に分化した細胞は敷石状またはトロホブラスト様細胞に似た形態となることがあります。分化した細胞はコロニーの境界、またはコロニーの中心部分に存在する場合があります。また渦巻いた凝集塊を含む分化したコロニー、胚様体のような小さなボール状の細胞に分化したコロニーが存在していることがあります。
- 1 もしメンテナンスや継代培養の必要がない場合は、安全キャビネット内で培地交換を行ってください(2.4.A)。
- 2 もし分化したコロニーが10%以上存在する場合は、分化したコロニーを除去する必要があります(2.4.B)。
- 3 大きく密なコロニーがある場合は、継代を行う必要があります(2.4.C)。
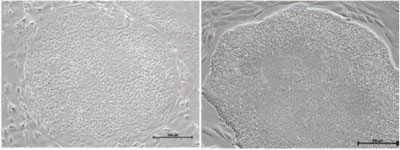
図6 フィーダー細胞(MEF)上で、NutriStem®(#05-100-1)を使用して培養したH1ヒトES細胞の典型的な形態
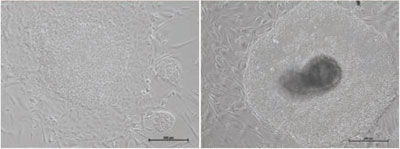
図7 フィーダー細胞(MEF)上で異常な形態のH1ヒトES細胞
2.2 フィーダー細胞の準備
フィーダー細胞はガンマ線照射、またはマイトマイシンC処理により増殖能を不活化しておく必要があります。
不活化フィーダー細胞は直ちに使用、または凍結保存しておくことができます。
不活化フィーダー細胞層は、播種してから7日間、ヒトES/iPS細胞ををサポートします。
| 2.2.1 | 0.1%ゼラチン溶液を室温まで温めます。 |
|---|
| 2.2.2 | 無菌条件下で6ウェルプレートの各ウェルにゼラチン溶液2mLを加えます。 |
|---|
| 2.2.3 | 室温で30分間インキュベートします。 |
|---|
| 2.2.4 | フィーダー細胞を播種する前に溶液を除きます。予め準備しておいた不活化フィーダー細胞を使用する場合は2.2.10へ、凍結保存しておいたフィーダー細胞を用いる場合は2.2.5へ進んでください。 |
|---|
| 2.2.5 | 液体窒素保管をしておいた凍結保存不活化フィーダー細胞のバイアルを取り出し、37℃ウォーターバスで迅速に解凍します。 |
|---|
| 2.2.6 | 凍結細胞の小片が残っている場合、70%エタノールを用いてバイアルを殺菌してください。 |
|---|
| 2.2.7 | 一度バイアルの内容物をピペッティングし、フィーダー細胞培地5mLを含むコニカルチューブへ少しずつ移していきます。 |
|---|
| 2.2.8 | 200xg、5分間遠心し、上清を捨てます。 |
|---|
| 2.2.9 | フィーダー細胞用培地で細胞ペレットを再懸濁します。使用する培地量は、播種するプレート各ウェル当たり2mLを目安にしてください(6ウェルプレートの場合2mL x 6=12mL)。 |
|---|
| 2.2.10 | ゼラチンコートしたウェルへフィーダー細胞懸濁液を加えます。 |
|---|
注意
1 培地を少しずつ添加することは細胞の回復に重要です。
2 播種するMEFの密度:実際に播種する細胞数については、MEFの製品添付説明書を参照してください。
一般的には6ウェルプレートの場合、継続的な培養を行っている場合は1ウェル当たり300,000cellsを播種してください。
凍結細胞を解凍して用いる場合、6ウェルプレートで1ウェル当たり500,000cellsを播種してください。
フィーダー細胞があまりにもまばらな場合は、ヒトES細胞の未分化能を維持できず、また接着も不十分となってしまいます。
フィーダー細胞が高密度の場合は、フィーダー層がプレートからはがれ、培養の継続が困難になることがあります。
2.3 NutriStem®を用いたヒトES/iPS細胞の解凍
| 2.3.1 | ヒトES/iPS細胞を解凍する一日前に、ゼラチンコートしたフィーダー細胞用培地入りの6ウェルプレートに不活化フィーダー細胞(例:マイトマイシンC処理MEF)でフィーダー層をプレートします。37℃、5% CO2で一晩インキュベートします。
注意:
1 フィーダー細胞プレートにヒトES/iPS細胞を解凍する場合は、常に7日以内に調製したプレートを使用する必要があります。
2 使用する前にフィーダー細胞の品質をチェックしてください(生存率が90%以上かどうか、通常の線維芽細胞の形態を有しているかどうか)。 |
|---|
| 2.3.2 | 温めたNutriStem?培地5mLを50mLコニカルチューブへ加えます。 |
|---|
| 2.3.3 | 液体窒素で保管してある凍結ヒトES細胞のバイアルを取り出します。 |
|---|
| 2.3.4 | バイアルの霜を取り除き、ラベルに情報を記録します。 |
|---|
| 2.3.5 | 37℃のウォーターバスで細胞を解凍してください。
※この際バイアルのキャップ部分まで水没させてしまうと、コンタミネーションの危険性が高まる為注意してください。
小さな氷の結晶が残っている状態まで解凍したら、バイアル全体を70%エタノールでスプレーし、ふき取ってください。 |
|---|
| 2.3.6 | 無菌安全キャビネット内で予め用意しておいた50mLコニカルチューブの5mLの培地に凍結保存バイアル中の細胞を移します。
コニカルチューブへ細胞を移すだびに緩やかに浸透しながら混和してください。 |
|---|
| 2.3.7 | 200xg、5分間遠心してください。 |
|---|
| 2.3.8 | 遠心を行っている間、フィーダー層プレートのラベル(細胞株名、継代数、細胞を解凍した日付等)を用意します。 |
|---|
| 2.3.9 | 遠心後のチューブを安全キャビネットへ運び、慎重に上清を除去します。
この際、細胞ペレットを吸引しないよう注意してください。上清にはDMSOが含まれるため、できるだけ上清の除去を行ってください。 |
|---|
| 2.3.10 | 5mLガラスピペットを使用してNutriStem?培地2mLを加え、3-4回穏やかにピペッティングしてペレットを再懸濁してください。 |
|---|
| 2.3.11 | 用意しておいたフィーダー細胞プレートからアスピレーターでフィーダー細胞培地を除き、1mLのDMEM:F12(1:1)を各ウェルへ加えます。
ゆっくりとまわすようにして培地でウェルを洗い、アスピレーターで除きます。そこへ温めたNutriStem? 1mLを加えます。 |
|---|
| 2.3.12 | ここへヒトES細胞懸濁液を1ウェル当たり2mL加えます。 |
|---|
| 2.3.13 | 細胞が均等にウェルへ行き渡るようにプレートを前後左右にスライドさせ、37℃インキュベーターへプレートを静置します。この際、中央にコロニーが集中してしまうのを避ける為、円を描くようにプレートをスライドさせないでください。 |
|---|
| 2.3.14 | 5% CO2、37℃で一晩インキュベートすることで細胞が接着します。細胞を解凍してから一日後、培地を除き(この際、接着していない浮遊細胞も除いてください)、新鮮なNutriStem?培地2-3mLを加えてください。オプション:除去した培地と浮遊細胞を別の新しいフィーダー層ウェルへ移すことができる場合があります。多くの場合、元の細胞と平行して培養することができ、新たなコロニーを形成します。 |
|---|
| 2.3.15 | 37℃、5% CO2で一晩インキュベートします。 |
|---|
2.4 オンフィーダー培養でのヒトES/iPS細胞の維持
A. NutriStem®培地を用いた流加培養
ヒトES/iPS細胞の最適なグロースの為には毎日培地を交換する必要があります。週末のみ、2倍量の培地を加える事で、二日後に培地交換をすることが可能です。ただし通常は、24時間以上培地交換を行わない培養、または常に一日置きの培地交換を行うことを継続する培養は推奨しません。
| 2.4.A.1 | 使用済み培地をアスピレーターで除去します。 |
|---|
| 2.4.A.2 | 各ウェルに温めたNutriStem?培地を添加します。添加量は6ウェルプレートの場合、3mL/1ウェルとなります。 |
|---|
| 2.4.A.3 | 5% CO2、37℃でインキュベートします。 |
|---|
B. 分化した細胞の除去
B1. 未分化なコロニーよりも分化したコロニーが多くなっている場合は、未分化なコロニーを選別することが望ましいです。
| 2.4.B1.1 | 使用済み培地をアスピレーターで除去します。 |
|---|
| 2.4.B1.2 | 各ウェルに温めたNutriStem?培地を添加します。添加量は6ウェルプレートの場合、3mL/1ウェルとなります。 |
|---|
| 2.4.B1.3 | 顕微鏡下でピペットチップを使用し、分化したコロニーを残しながらできるだけ多くの未分化なコロニーをピックアップします。 |
|---|
| 2.4.B1.4 | 新しいフィーダー細胞コートプレートに、浮遊コロニーを含む回収した培地上清を移します。コロニーが大きすぎる場合はピペットで慎重にコロニーを小さくなるようにばらしてください。ただし、コロニーが小さくなりすぎないよう注意が必要です。 |
|---|
B2. 培養中のコロニーが未分化なもので占められている場合は、分化したコロニーを除くことが好ましいです。
| 2.4.B2.1 | 顕微鏡下でピペットチップを用いて分化した領域を除去します。 |
|---|
| 2.4.B2.2 | 分化した浮遊細胞を含む培地をアスピレーターで除去します。 |
|---|
| 2.4.B2.3 | 温めた新鮮なDMEM:F12(1:1)で一度ウェルを洗浄します。 |
|---|
| 2.4.B2.4 | 各ウェルに温めたNutriStem?培地を添加します。添加量は6ウェルプレートの場合、3mL/1ウェルとなります。 |
|---|
| 2.4.B2.5 | 5% CO2、37℃でインキュベートします。 |
|---|
C. 継代培養
下記は、フィーダー細胞(MEF、HFF等)上で培養するヒトES細胞用のプロトコルとなります。
| 2.4.C.1 | ウェルからアスピレーターで使用済み培地を除去します。 |
|---|
| 2.4.C.2 | 温めたDMEM:F12(1:1)で一度ウェルを洗浄します。 |
|---|
| 2.4.C.3 | 温めたコラゲナーゼIV(1mg/mL)1mLを各ウェルへ添加します。 |
|---|
| 2.4.C.4 | プレートを37℃のインキュベーターへ戻し、最大1時間までインキュベートします。5-10分毎にチェックし、細胞をコラゲナーゼIVに過剰に曝さないよう注意してください。 |
|---|
| 2.4.C.5 | 顕微鏡下でコロニーを確認し、コロニーが接着した状態のまま端がそり始めるまでインキュベートします。
注意: 解離の処理を長くするとフィーダー細胞がプレートに付着したままコロニーが分離します。このような場合は2.4.C.10へ進んでください。 |
|---|
| 2.4.C.6 | 穏やかにコラゲナーゼ溶液をアスピレーターで除去し、DMEM:F12(1:1)で少なくとも一度洗浄します。 |
|---|
| 2.4.C.7 | 2mLのNutriStem?培地を添加します。 |
|---|
| 2.4.C.8 | 5mLガラスピペットで優しくコロニーをはがしとり、培地中へよく洗い流してください。 |
|---|
| 2.4.C.9 | ウェルからコロニーが全て解離するまでこの操作を3-4回繰り返します。この際にコロニーが小さくなりすぎないよう注意してください。 |
|---|
| 2.4.C.10 | 解離したコロニーを新しい無菌の50mLコニカルチューブへ移します。 |
|---|
| 2.4.C.11 | 新たに2mLの培地を用いてウェルを洗浄し、2.4.C.10の50mLコニカルチューブへ移します。 |
|---|
| 2.4.C.12 | 200xg、5分間遠心をします。 |
|---|
| 2.4.C.13 | 遠心を行っている間、新しいフィーダー細胞層コート6ウェルプレートを準備しておきます。DMEM:F12(1:1)で一度ウェルを洗浄し、やさしく2mLのNutriStem?を各ウェルへ添加します。 |
|---|
| 2.4.C.14 | 遠心後、細胞ペレットを崩さないように注意しながら上清を除きます。 |
|---|
| 2.4.C.15 | 細胞ペレットを1mLのNutriStem?培地で再懸濁します。継代比率=1:6としたい場合は6mLの培地を使用してください。
注意:通常NutriStem?の継代比率は、3-5日毎に1:6-1:8です。 |
|---|
| 2.4.C.16 | コロニーが希望のサイズになるように穏やかにピペッティングします。 |
|---|
| 2.4.C.17 | やさしく均等に1mLの懸濁したヒトES細胞塊を新しいウェルへ播種します。 |
|---|
| 2.4.C.18 | 細胞が均等にウェルへ行き渡るようにプレートを前後左右にスライドさせ、37℃インキュベーターへプレートを静置します。 |
|---|
| 2.4.C.19 | 37℃で一晩インキュベートし、細胞を接着させます。 |
|---|
| 2.4.C.20 | ES細胞のコロニーが次の継代に十分な大きさになるまで毎日新鮮な培地を交換してください。 |
|---|
2.5 凍結保存
BLG社ではヒトES細胞の凍結保存にCryoStemの使用を推奨しております。CryoStemはanimal component-freeで、血清不含有の凍結保存液です。メチルセルロース、DMSOを含みます。血清を含む他の凍結保存培地との比較試験でも、凍結融解後に高い生存率、接着率が保持されることが示されています。下記は6ウェルプレートでヒトES/iPS細胞を培養した場合のプロトコールとなります。ウェルが60-70%コンフルエントに達しましたら凍結保存を行います。凍結前のヒトES/iPS細胞は、分化率が10%未満の状態である必要があります。
注意
一般的には6ウェルプレートで培養した場合は、1つのウェルの細胞を1バイアルに保存してください(凍結保存液量はCryoStem保存液1mL/1バイアルです)。
| 2.5.1 | 凍結保存用のバイアルとCryoStem凍結保存培地を使用するまで氷上に静置しておきます。
(予め分注しておいたCryoStem培地を用意されておくことをおすすめします) |
|---|
| 2.5.2 | 2.4.C継代培養のステップ2.4.C.1から2.4.C.11に記載した方法でコロニーを回収します。 |
|---|
| 2.5.3 | 200xg、5分間遠心します。 |
|---|
| 2.5.4 | 遠心を行っている間、安全キャビネット内で凍結保存バイアルに細胞株名、継代数、日付等を記載したラベルを添付します。 |
|---|
| 2.5.5 | 遠心後、細胞ペレットを崩さないように注意しながらアスピレーターで上清を除去します。 |
|---|
| 2.5.6 | 1つのウェルから回収したコロニーのペレットに対して、氷上で冷やしておいたCryoStem培地1mLで再懸濁を行います。 比較的大きなコロニー塊で保存することでES細胞のリカバリーが高まるので、極めて穏やかにペッティングを行います。 |
|---|
| 2.5.7 | 迅速に、ただし穏やかに1mLの細胞懸濁液を凍結保存バイアルへ加えます。 |
|---|
| 2.5.8 | バイアルをイソプロパノール凍結容器(例:品番5100-0001 Mr.Frosty)へ移し、−80℃で一晩保管します。
※Mr.Frostyでは1℃/minの温度レートで凍結されます。 |
|---|
| 2.5.9 | 次の日に凍結保存バイアルを液体窒素中へ保管します。 |
|---|
2.6 オンフィーダー培養からフィーダーフリー培養への移行
NutriStem®培地はオンフィーダー培養、フィーダーフリー培養どちらにもお使いいただくことが可能です。
| 2.6.1 | 5%(v/v)のBio-Pure HSA(Cat # 05-720-1)をAF NutriStem?(品番05-102-1)へ加えます(終濃度:0.5%(w/v))。例えば、5.35の10% Bio-Pure HASを1005のAF NutriStem?(品番05-102-1)へ添加します。 |
|---|
| 2.6.2 | 細胞を継代培養します。 |
|---|
| 2.6.3 | Matrigel? コートプレートに直接播種します。 |
|---|
ある程度残留したフィーダー細胞が初めの2週間ほど観察されるかもしれませんが、その後の継代によりこれらの細胞は除かれていきます。NutriStem® with Human Serum Albumin(Xeno Free)(品番05-100-1)はオンフィーダー培養、フィーダーフリー培養のどちらにも適しています。上記と同様の方法でフィーダーフリー培養からオンフィーダー培養への移行も可能です。
 商品情報 NutriStem® ヒトES 細胞&ヒトiPS 細胞培養用無血清培地
商品情報 NutriStem® ヒトES 細胞&ヒトiPS 細胞培養用無血清培地