技術情報
検証データ 1 :2つのpMOTHERベクターからE.coli pDAUGHTERベクターに遺伝子挿入配列を移動
・pMOTHERプラスミド:Kringle黄色蛍光タンパク質(Kringle YFP)を2つのpMOTHERベクターにクローニングした。
1. pMOTHER264:pUC複製起点、Amp耐性、rpsLカウンター選択マーカー
2. pMOTHER268:pUC複製起点、Amp耐性、PheSカウンター選択マーカー
・SapI 切断済みpDAUGHTERベクター
- pDAUGHTER441-SR:誘導型T5プロモーター、強力なRBS、Kan耐性、pUC複製起点
● 実験手法
1. pMOTHERベクターからpDAUGHTERベクターへのORF移動反応は、右表の通り1本の1.5mLチューブ内で行った。
2. 反応溶液は、5, 10, 20, 40 または60分間、室温で培養した。
3. 各反応溶液より2.5μ l を分取し、50μ l のNEB 10-beta Competent E.coli に形質転換した。各形質転換溶液100 μ l は、30μg/mL のカナマイシンを含むLB寒天培地、または30μg/mL のカナマイシンおよび100μg/mL ストレプトマイシンまたはYEG(フェニルアラニン類似体)を含むLB寒天培地に播種した。
4. MOTHER/DAUGHTERの組合わせごとに、カナマイシン寒天プレートおよびカナマイシンとストレプトマイシンまたはクロロフェニルアラニン寒天プレートそれぞれより48個のコロニーを拾い、核酸配列を検証した。95%以上の形質転換体において、正しい挿入配列が確認できた。
| 試薬 | 量(μL) |
|---|---|
| Mother V ector (30 ng final) | 3 |
| Daughter V ector (3 ng final) | 1 |
| Electra Buffer Mix (1 X) | 2 |
| Electra Enzy me Mix (1 X) | 1 |
| ddH2O | 13 |
| T otal Volume | 20 |
● 結果
KringleYFP遺伝子を、rpsLカウンター選択遺伝子(pMOTHER264, 図.4 左)またはPheSカウンター選択遺伝子 (pMOTHER268, 図.4 右)をもつアンピシリン耐性pMOTHERベクターに挿入した。各pMOTHERベクターは、SapI、T4 DNAライゲース、およびATPとともに誘導型T5プロモーターをもつ開環済みE.coli pDAUGHTER(pDAUGHTER441-SR)と混合した。所定時間培養後、反応溶液をE.coli NEB-10-beta Competent cell に形質転換し、カナマイシンのみ(青線)、またはカナマイシンとMOTHERカウンター選択要素(赤線)を含む栄養寒天培地に播種した。MOTHER DNA、DAUGHTER DNA、IIS 型制限酵素SapI およびT4DNAライゲースを1つのチューブに加えることで、pMOTHERベクターとpDAUGHTER ベクター間でYFP断片が交換され安定してプラスミドが産生する。この反応はわずか5分で生じ、25℃、40分で完了する。
| 時間 | CFU/100μl 1:100 希釈溶液を播種 | CFU/100μl 1:100 希釈溶液を播種 | ||
|---|---|---|---|---|
| LB+Kan | LB+Kan+Strep | YEG+kan+chlorophe | ||
| pM264 x pDAUGHTER (T5) | pM268 x pDAUGHTER (T5) | pM264 x pDAUGHTER (T5) | pM264 x pDAUGHTER (T5) |
|
| 5分 | 35 | 18 | 39 | 21 |
| 10分 | 87 | 67 | 115 | 68 |
| 20分 | 252 | 202 | 332 | 222 |
| 40分 | 423 | 381 | 432 | 421 |
| 60分 | 383 | 367 | 380 | 363 |
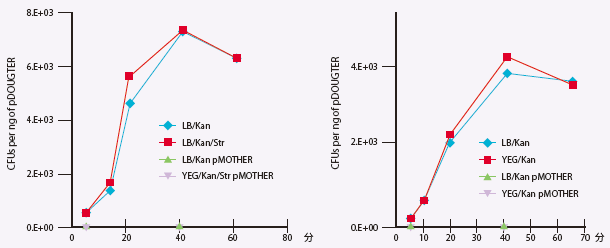
図4. E.coli pDAUGHTER発現ベクターを用いたElectra system™ のクローニング経時変化
● まとめ
KringleYFP(黄色蛍光タンパク質)をコードするpMOTHERベクターと E.coli 発現型pDAUGHTERベクターとをElectra Reagent Mix 存在下で混合し、5〜60分間反応させた。反応溶液をコンピテントセルに形質転換した後、適切な選択用抗生物 質を含むLB寒天プレートに播種した。わずか5分の反応で形質転換体が得られ、反応は40分で終了することが示唆された。ほぼ全ての形質転換体から誘導性の黄色蛍光の表現型がみられたことから、遺伝子がpMOTHERからpDAUGHTER発現ベクターへ正確に移行したことがわかる。MOTHERとDAUGHTERでは異なる抗生物質を使用する必要があるため、ここでは当該 DAUGHTER構築を選択した。形質転換混合液にはMOTHERとDAUGHTERの両方の構築が含まれるため、DAUGHTERが導入された細胞にMOTHERも同時に導入される可能性がある。そのため、MOTHERベクターもrpsL(ストレプトマイシン感受性) またはPheS(フェニルアラニン類似体p-クロロフェニルアラニン感受性)の何れかのカウンター選択マーカーが加えてある。 DAUGHTER用の選択抗生物質とMOTHER用のカウンター選択試薬の両方を含む培地に形質転換体を播種することでMOTHERをもつ形質転換体を完全除去(PheS)または減数(rpsL)できる。
PCR産物を事前の処理やクリーンアップなしにElectra one tube reaction 手法でpDAUGHTERベクターにクローニング可能か確認することを目的とした。
● 実験手法
1. 黄色蛍光タンパク質(KringleYFP)を下記プライマーを用いて増幅した。
107888A-ampF:
TACACGTACTTAGTCGCTGAAGGGGAAGTCTTCGCTCTTCTATGACGGCACTGACTGAAGGCGCAAAACTGTTCGAG
107888A-ampR:
AGGTACGAACTCGATTGACGTTTTTAGTCTTCGCTCTTCTACCTTAACGGTACGTTTCCAGGTCAACTGCCTTGATC
2. 各反応溶液より5μL を1%アガロース-TBEゲルで電気泳動した。750bpにおいて強くはっきりとした推定濃度(100ng/μ l)の増殖産物のバンドがみられた。
3. 2ngの開環状pDAUGHTERベクターと200ngのPCR反応溶液を用いて、PCR産物のpDAUGHTERベクターへのElectraクローニングを行った。反応溶液は室温で5分間培養した。
4. 各反応溶液より2.5μ l を50μ l のNEB10-beta Competent E.coli に形質転換し、100μ l の各形質転換溶液を寒天培地に播種した。
● 結果
何千もの黄色コロニーが得られ、挿入配列を持たない白色コロニーは5%未満であった。未精製のPCR産物をPCR反応の処理や精製なしで、室温で5分間反応させるだけでpDAUGHTERベクターにクローニング可能であることが示唆された。つまり、対象遺伝子をPCR増幅し、DAUGHTERベクターに効率よくクローニングできる可能性がある。Electra cloning system、ATUM社のDAUGHTER発現ベクターを利用することで、PCRを用いて研究対象遺伝子のORFをさまざまな宿主発現システムに効率よく移行できることが示唆された。
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては
使用しないように、十分ご注意ください。

























