技術情報
クローニングシステム
クローニング手順(古典的なクローニング)
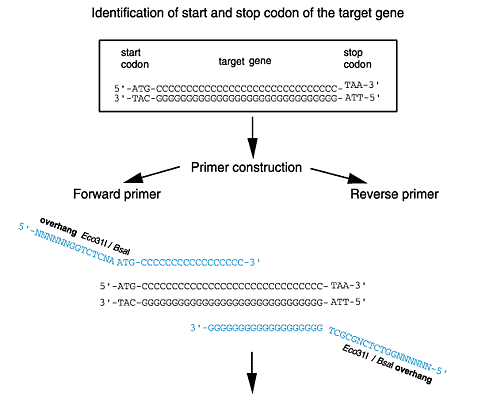
発現システムのポリリンカーには制限酵素サイトBsaI(Eco31Iのイソ制限酵素)及びBsmFI(New England Biolabs, MBI Fermentas)が含まれ、ベクターがコードする機能的エレメント(Strep-tag® II、6xヒスチジンタグ、ベクターによっては、OmpA-シグナル配列、スタートコドン、プロテアーゼ切断サイト、ストップコドンなど)の構造遺伝子を正確に融合させます。構造遺伝子をコードしている領域の両末端にPCRでつなげること簡単に作製できます。
pASK-IBA3のクローニング手法を示します(下記クローニングスキーム参照)。異なるベクターを用いる場合は、適宜方法を調節してください。各ベクターのための重要なプライマー配列は、ここに記載していますが、Primer D'Signerソフトウェアもご利用いただけます。
その他の制限酵素サイトをクローニングに使用する場合は、構造遺伝子とベクターがコードする機能的エレメントをインフレームで融合するようにご注意ください。 N末端にアフィニティタグを持つpASK-IBA4からpASK-IBA7まで、pASK-IBA35、pASK-IBA37、pASK-IBA44、pASK-IBA45ベクターでは、4種類の制限酵素(KasI、NarI、EheI、BbeI)によって認識されるリンカー配列( 5'-GGCGCC-3')の後にタグが続きます。4種類の制限酵素は、異なる方法でリンカー配列を切断します。このように、ターゲット遺伝子を特殊なリーディングフレームに挿入する場合に備えて、対応する酵素による切断及び連続する反応により、全てのリーディングフレームを平滑末端で作成することが可能になります。
塩基置換の組み込みを防ぐために、プルーフリーティングDNAポリメラーゼ(Bioneer社のPfuなど)によるPCRを行う必要があります。プルーフリーティング活性による3'5'分解を防ぐため、3'をホスホロチオエートで保護したプライマーを用います。
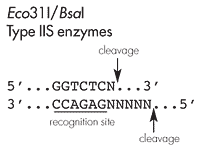 |
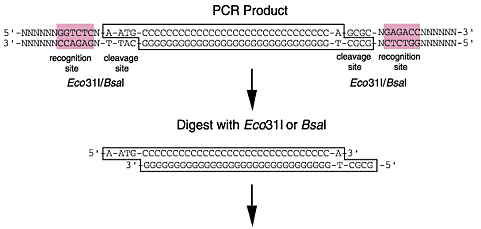
Eco31I及びBsaIは、タイプIISの制限酵素に属し、DNA二本鎖をその認識領域の外側で切断します。これにより、単一酵素で2つの独立した突出末端(5'末端が4塩基突出)を作り出し、定方向クローニングが可能になります。加えて、分解反応により、アミノ酸配列及びタンパク質発現のコード部分に影響することなく、認識配列を除去することができます。 |
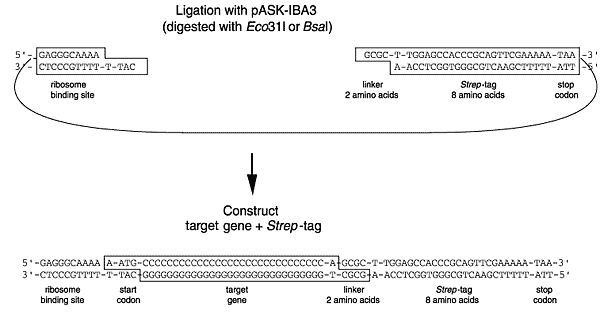
クローニングスキーム(pASK-IBA3の実例)
*異なるベクターを用いる場合は、適宜方法を調節してください。
発現システム
Tetプロモーター
pASK-IBAベクターは、厳しく管理されたtetプロモーターにより機能します。tetリプレッサーは、pASK-IBAプラスミド上にコードされ、βラクタマーゼプロモーター又はクロラムフェニコールアセチルトランスフェラーゼプロモーターから恒常的に発現されます。この特殊な配列により、リプレッサー分子とプラスミドコピー数は、化学量論的にバランスが取れていることが保証されます。外来遺伝子の発現は、低濃度のアンヒドロテトラサイクリンにより効率的に化学誘導されるまで、厳密に抑制されます。lacプロモーターが、漏出性で、異化代謝産物抑制(cAMPレベル、代謝状態)に敏感で、染色体にコードされたリプレッサー分子によって影響を受けるのと対照的に、tetAプロモーター/オペレーターは、厳密にコントロールすることができ、機能的に細胞の調節メカニズムや遺伝的バックグランドの影響を受けることがありません。
その結果、特別なE. coli株や過剰なプラスミドが不要で、広範囲の培地や培養条件を使用することができます。例えば、最小グルコース培地や、XL1-Blueバクテリア株(テトラサイクリン耐性遺伝子のエピソームのコピーを持つ)でさえ、発現に使用することができます。pASK-IBA発現システムは、発酵を含む幅広い条件に適用できる扱いやすいシステムです。
ベクターには更に、効果的な翻訳開始を確実にする直列型のリボソーム結合サイト(RBS)、リポタンパク質のリードスルーを防ぐための強力なターミネーター、バクテリオファージf1の遺伝子間領域(ssDNA及びβラクタマーゼ又はクロラムフェニコールアセチルトランスフェラーゼ遺伝子*を準備するための領域)が含まれます。また、ベクターは、テトラサイクリンに対する耐性を媒介しません。
*βラクタマーゼ耐性遺伝子を持つクローニングベクターは、細菌培養培地中でアンピシリンがすぐに分解されてしまうことから、使用が制限されることがあります。従いまして、アンピシリン耐性の代わりにクロラムフェニコール耐性のStrep-tag® IIベクターpASK-IBA2C〜pASK-IBA7Cも取り扱っております。
Reference:
Skerra, A. (1994). Use of the tetracycline promoter for the tightly regulated production of a murine antibody fragment in Escherichia coli. Gene, 151, 131-135.
テトラサイクリンよりも35倍強く結合するアンヒドロテトラサイクリン(AHT)
Strep-tag®/Strep-Tactin®過剰発現システムのE. coli 発現カセットは、tetAプロモーター/オペレーターの転写調節下にあります。プロモーターを誘導するアンヒドロテトラサイクリン(AHT)は低濃度で、コストを削減でき、AHTの抗菌作用を最小限に抑えます。Degenkolbら(1991)は、AHTがテトラサイクリンよりも35倍tetリプレッサーに強く結合することを示しました。
ジスルフィド結合の形成
いくつかのベクターは、N末端にompAシグナルペプチドを融合しており、E. coliのペリプラズム空間へのリコンビナントタンパク質の分泌を媒介します。ペリプラズムにおいて、シグナルペプチドはE. coliのシグナルぺプチダーゼにより選択的に切断されます。このような分泌手法は、自然に分泌されるタンパク質中にしばしば存在するジスルフィド結合を構造的に含むタンパク質の生成に不可欠です。E. coliの細胞質内の還元された環境では、ジスルフィド結合の形成が妨害され、未フォールドペプチドが凝集又は分解されてしまうことがあります。
最初の精製工程としてのペリプラズム分泌
加えて、ペリプラズムへの分泌により、リコンビナントタンパク質を細胞質のプロテアーゼから隔離することができます。E. coliの外膜は、EDTAやリゾチームなどの穏やかな処理により、選択的に分解することができるため、細胞質の構成成分を含むスフェロプラストは、遠心により簡単に除去することができます。
活性成分の追加
また、ペリプラズム空間は、600Daを超える分子が到達でき、培地に活性成分を添加することで、発現しているリコンビナントタンパク質のフォールディングや安定性に影響を与えることができます(酸化還元成分、非代謝性糖、リコンビナントたんぱく質のリガンドなど)。
細胞質又はペリプラズムでの発現
細胞質のリコンビナントタンパク質が、ストップトランスファー配列を含まない限り、このタイプのタンパク質もペリプラズム分泌の利点を受けます。しかし、ストップトランスファー配列は予測が困難なため、両方の方法を平行して検討することをお奨めします。N末端のStrep-tag® II又は6xヒスチジンタグ融合にベクターを使用し、5'-末端及び3'-末端のそれぞれNheI/BstBI及びEcoRV/HindIII 制限酵素部位を介した簡単なクローニングステップにより、細胞質からペリプラズムへ(又はその逆)発現を変化させることができます。
確実なタンパク質が必要な場合
確実なタンパク質が必要な特別なアプリケーションのために、タグの完全除去が可能な、N末端のStrep-tag® II又は6xヒスチジンタグに隣接してXa因子プロテアーゼ切断部位をコードしたベクターをご利用いただけます。

15kDaのセレン含有タンパク質(N末端にStrep-tag®を含む)を22℃でXa因子(1:1000, w/w)処理した。タンパク質をコードした遺伝子は、Strep-tag® IIに隣接してXa切断部位を含むpASK-IBA6ベクターにクローニングした。
レーン1:Xa未処理、レーン2:Xa処理1時間、レーン3:Xa処理2時間、レーン4:Xa処理4時間、レーン5:Xa処理16時間(Strep-tag® IIタグの無いタンパク質)
菌株
以下のE. coli株は、pASK-IBAベクターを用いたtet発現系で、既に使用されています。
JM83, WK6, B, BL21, MG1655, W3110, BL21(DE3), BLR(DE3), XL1-Blue, BL21-CodonPlus™-RIL 分泌にはJM83株をお奨めします。また、精製の際にタンパク質を分解してしまうIonプロテアーゼ及び外膜プロテアーゼを欠損しているため、細胞質発現にはE. coli B株をお奨めします(Grodberg and Dunn, 1988, J.Bacteriol. 170, 1245)。
Tet発現系と互換性のないE. coli株がある可能性もあるので、ご注意ください。
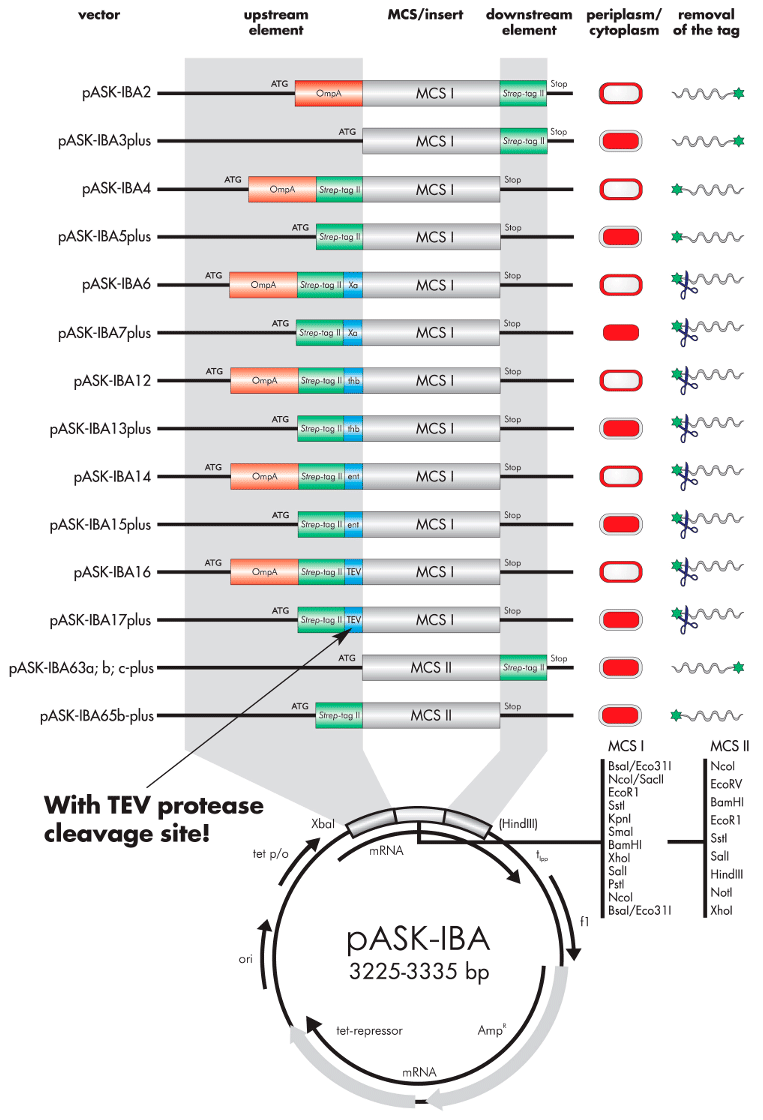
Strep-tag ベクター機能概要
Strep-tag® ベクター
E. coli発現のために、Strep-tag®のついたリコンビナントタンパク質の発現が可能なpASK-IBAベクターを、各種ご用意しております。pASK-IBAベクターは、抗生物質耐性遺伝子(AmpR、CamR)を除くと、XbaI及びHindIII制限酵素部位のみ異なっています。具体的な差異は以下のベクターマップをご参照ください。N末端又はC末端、ペリプラズム発現又は細胞質発現、タグ除去用のエンドプロテアーゼ切断部位(Xa因子、エンテロキナーゼ、トロンビン、TEVプロテアーゼ)などからご選択いただけます。通常はタグを除去する必要がないことにご注意ください。
pASK-IBAplusベクター
Strep-tag® II又は6xヒスチジンタグ融合タンパク質発現のために既に確立されている、細胞質pASK-IBベクターは、現在は「plus」バージョンとして提供しております。この新しいバージョンでは、主要タンパク質の収率を向上させる改良翻訳開始サイトを含みますが、それ以外の配列は「plus」を含まない旧バージョンと同一です。「plus」を含まないバージョンは、今後はご要望があった場合のみ提供いたします。
下図で、Strep-tag® II及び/又は6xヒスチジンタグを持つリコンビナントタンパク質を発現できるpASK-IBA E. coliベクターのリストをご確認いただけます。
pASK-IBAベクターマップ
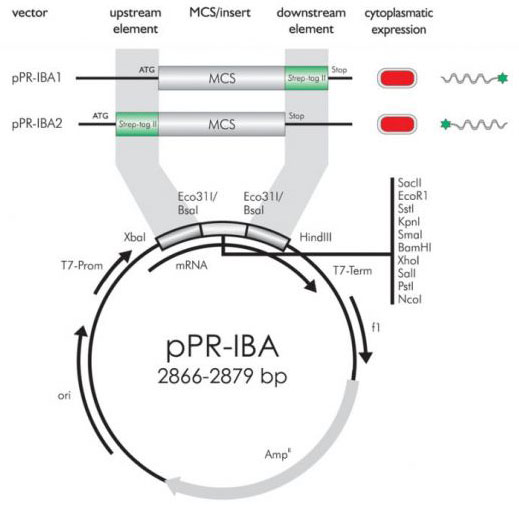
pPR-IBAベクターマップ (T7 promoter)
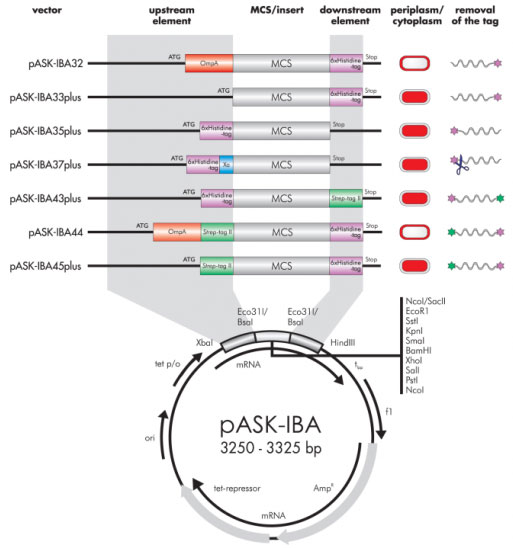
6xヒスチジンタグ及びダブルタグベクターの特徴
Strep-tag®ベクターに加えて、6xヒスチジンタグベクター、Strep-tag®と6xヒスチジンタグの両方を持つダブルタグベクターをご用意しております。2種類の異なるアフィニティタグをタンパク質につけることで、高度な精製が可能で、変性条件又は生理的な条件下で全長タンパク質のを精製できます。また、培養培地から直接精製するプロトコールを最適化することも可能です。
6xヒスチジンタグ及びダブルタグベクターマップ
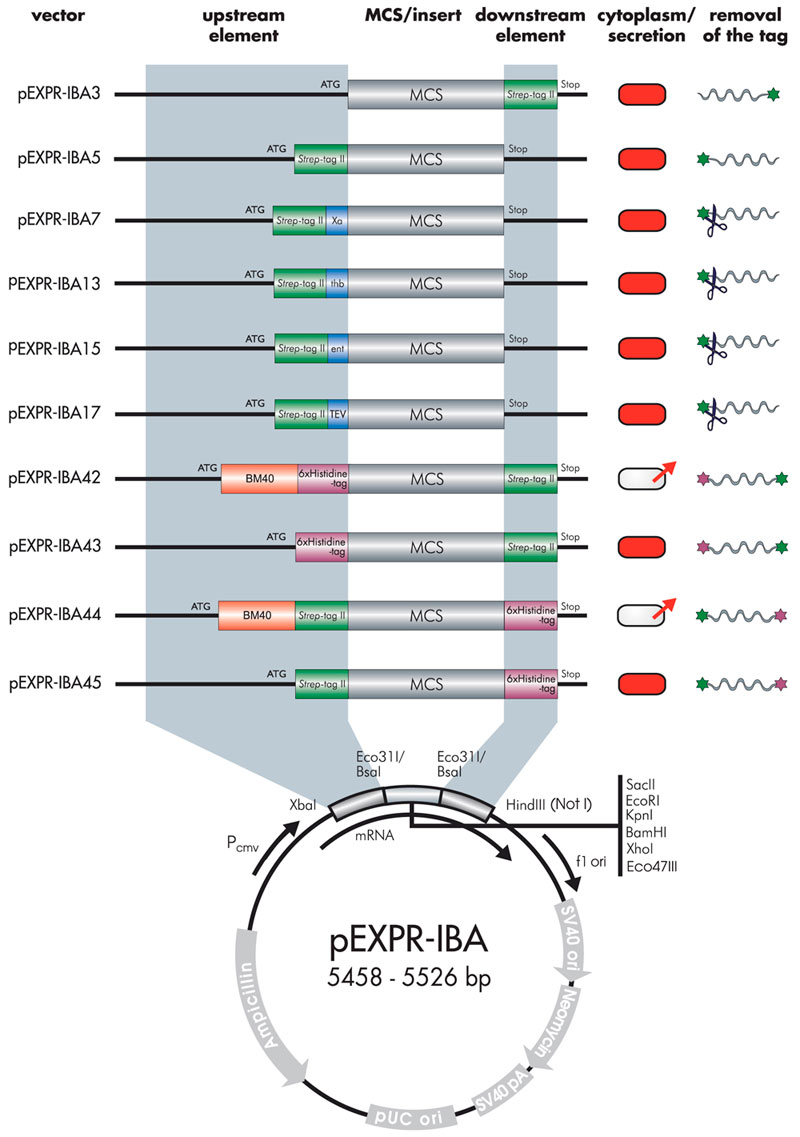
pEXPR-IBA 哺乳類細胞発現ベクター
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては
使用しないように、十分ご注意ください。
























