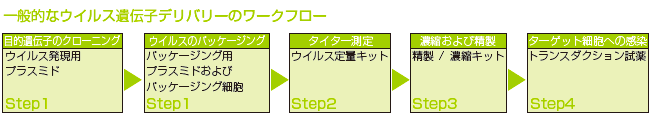
I. 精製
※下記の方法は、2.5mLのアデノ随伴ウイルス(AAV)上清の精製及び濃縮用に記載しています。
※ 2.5mLより少ないウイルス上清をご使用される場合は、血清フリーのDMEMを加え2.5mLに調製して下さい。
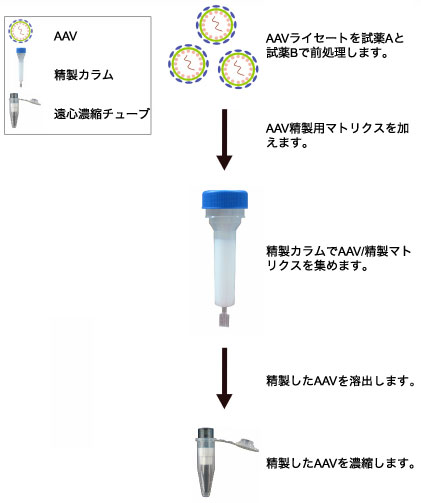
1. 25μLのViraBind™ AAV Reagent Aを2.5mLのウイルス上清に加えてよく混合します。
2. 37℃で30分間インキュベーションします。
3. AAV上清を15分間 5,000×gで遠心します。
4. 上清を注意深く回収し、新しいチューブに移します。ペレットは捨てます。
5. ViraBind™ AAV Reagent Bを30-60分間37℃で確実に溶かします。125 μLのViraBind™ AAV Reagent Bを4.のViraBind™ AAV Reagent Aで処理した2.5mLのウイルス上清に加えてよく混合します。
6. 37℃で30分間インキュベートします。
7. 10,000×g,10分間遠心し、AAVの上清を回収します。ペレットは捨てます。
8. AAVの上清を15mLのコニカルチューブに移します。
9. 遠心した上清に、300μLのAAV Purification Matrixを加え、ゆっくり混ぜます。
10. 上清とMatrixを混ぜ合わせた懸濁液を4℃、30分間オービタルシェーカーで混ぜます。
11. 1,000rpm,10分間遠心分離し、ペレットを得ます。
12. 注意深く、上清を除き、Purification Buffer 2.5mLで洗浄します。
13. 11-12のステップをもう一度行います。
14. 注意深く最後の洗浄液を除きます。
15. 0.5mLのElution Bufferを加え、Purification matrixから精製されたAAVを溶出します。
16. 4℃で10分間、オービタルシェーカーで混合します。
17. 溶出分画を集め、10分間1,000rpmで遠心します。
18. 注意深く上清を取り除きます。
II. バッファー置換と濃縮
1. 遠心型濃縮用チューブを通り組み立てます(図2)。
2. 0.5mLのリカバーしたAAVフラクション(上記ステップ18)を遠心型濃縮用チューブ内のsample reservoirにアプライします。濃縮用チューブを卓上型遠心機に入れ、2,000×gで5分間遠心します。フロースルーは廃棄します。
3. AAVフラクションを100μLになるまでsample reservoir内で濃縮します。
4. 400μLのPBSまたはご希望のバッファーを濃縮用チューブに加え、100μLになるまで遠心します。4の操作をもう一度繰り返します。
5. ご希望の量まで濃縮します。
6. 新しいリカバリーチューブを用いて、濃縮されたサンプルを回収します。

図2 遠心型濃縮用チューブ
 AAV-DJ ヘルパーフリー発現システム (品番:VPK-410-DJ)
AAV-DJ ヘルパーフリー発現システム (品番:VPK-410-DJ) 293AAV Cell Line (品番:AAV-100)
293AAV Cell Line (品番:AAV-100) ViraBind™ アデノ随伴ウイルス精製キット (品番:VPK-140)
ViraBind™ アデノ随伴ウイルス精製キット (品番:VPK-140) QuickTiter™ アデノ随伴ウイルス定量キット (品番:VPK-145)
QuickTiter™ アデノ随伴ウイルス定量キット (品番:VPK-145) ViraDuctin™ アデノ随伴ウイルストランスダクションキット (品番:AAV-200)
ViraDuctin™ アデノ随伴ウイルストランスダクションキット (品番:AAV-200)