SEPHAROSE®はGE Healthcare社の登録商標です。
!各試薬の組成につきましては、「3.準備するもの」の項をご参照ください。
1) 可溶性クロマチン分画の調整
1〜5 x 106細胞※1を1 mLの細胞培養用メディウム※2に懸濁し、1.5 mLシリコナイズチューブに入れます。
↓
100 μLの11 X fixation solutionを加え※3(formaldehyde 1% final)、ローテーターにて5〜10分間室温で※4攪拌します。
↓
100 μLの1.5 M glycineを加え、ローテーターにて5〜10分間室温で攪拌。メディウムのフェノールレッドの色が黄色に変わります。Glycineは formaldehydeと反応し、クロスリンク反応を止めます。
↓
3000 rpm 5分間4℃にて遠心し、上清をアスピレーターで除き、細胞をボルテックスにて懸濁します。
↓
1 mLのFACS solutionを加え細胞を懸濁し、ローテーターにて5〜10分間4℃で攪拌します。
↓
3000 rpm 5分間4℃にて遠心し、上清をアスピレーターで除き、細胞をボルテックスにて懸濁。
↓
200 μLのSDS lysis buffer(細胞を懸濁・溶解する前にon iceにするとSDSが析出するので注意)を加え、ピペットマンP-1000を用いて10回程度ピペッティングし細胞を懸濁・溶解します。この時、泡を立 てないようにしましょう。
↓
氷上に10〜20分間静置。
↓
密閉式超音波細胞破砕装置Bioruptorを用いて、power high, on 30秒, off 1分のサイクルで7.5分間(5〜6サイクル)氷水で冷却しながら超音波処理を行います※5。
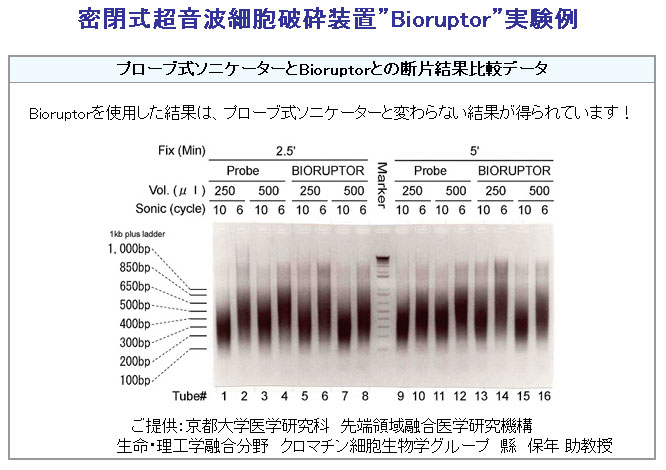
”Bioruptor”を用いた実験データ
↓
15 krpm 10分間4℃(SDSが析出する場合は8℃程度に設定するとよい)にて遠心し、上清(約200 μL)を2 mLシリコナイズチューブに回収。1800 μLのChIP dilution buffer(ice-cold)を加え希釈します。この内200 μLをInput分画として4℃で保存します。
2) 免疫沈降
上記の可溶性クロマチン分画(約1800 μL)に60-120 μLの50% Protein G Sepharose®/ salmon sperm DNA slurryを加え、ローテーターにて2〜6時間4℃にて攪拌します。
10 krpm 10秒間4℃にて遠心し、上清を回収し、約580 μLずつ3本の1.5 mLシリコナイズチューブに分注します。
↓
それぞれに、(1) normal rabbit IgG(コントロール抗体)、(2) 抗アセチル化ヒストンH3抗体、(3) 抗アセチル化ヒストンH4抗体を2〜4 μLずつ加え※6、ローテーターにて一晩(12〜16時間)4℃にて攪拌します。
↓
それぞれに20 μLの50% Protein G Sepharose®/ salmon sperm DNA slurry※7を加え、ローテーターにて2〜3時間4℃にて攪拌します。
↓
同様に(10 krpm 10秒間4℃にて)遠心し、上清を回収し、Unbound分画として4℃で保存します。
↓
Sepharose®ビーズを1 mLの以下のバッファーで洗浄します。各段階は、バッファーを加えた後、ローテーターにて5分間4℃にて攪拌し、同様に遠心、上清を除く操作を行います。 バッファーはice-coldに冷やしたものを用いましょう。抗体によってはこの洗浄の条件を検討してください。
(1) 1 X RIPA buffer/ 150 mM NaCl 1回
(2) 1 X RIPA buffer/ 500 mM NaCl 1回
(3) LiCl wash solution 1回
(4) 1 x TE 2回
3) DNAの精製
200 μLのChIP direct elution bufferをSepharose®ビーズに加え、ボルテックスにて懸濁します。同様に遠心。Sepharose®ビーズはフェノール/CIAA処理まで除く必要はありません※8。65℃にて4時間以上加熱し、クロスリンクをはずします。Input分画とUnbound分画もこの段階から平行して処理しましょう。
↓
1μLの4 mg/mL RNase Aを加え、ボルテックスにて攪拌し、同様に遠心後、37℃にて30分インキュベート。
↓
1μLの10 mg/mL proteinase Kを加え、ボルテックスにて攪拌し、同様に遠心後、55℃にて1時間インキュベート。
1〜2 μLの20 mg/mL Glycogenを加え、ボルテックスにて攪拌し、同様に遠心し、Sepharose®ビーズを残して上清を1.5 mLシリコナイズチューブに移します。
↓
210 μLのフェノール/CIAAを加え、ボルテックスにて攪拌し、15 krpm 3分間室温にて遠心し、上清(約200 μL)を1.5 mLシリコナイズチューブに回収します。有機層に180 μLの1 x TE- 200 mM NaClを加え、ボルテックスにて攪拌し、15 krpm 3分間室温にて遠心しましょう(back extract)。上清を回収し、先程の上清分画にプールし、ボルテックスにて攪拌後、同様に遠心します。
↓
800〜900 μLの100%ethanolを加え、tiltingにてよく攪拌し、-20℃にて2時間以上静置。15 krpm 30分間以上4℃にて遠心し、上清を除き、DNAの沈殿をice-coldの75% ethanolでリンスします。15 krpm 5〜10分間4℃にて遠心し、ピペットマンのチップにて上清を完全に除きましょう。5〜10分程度air dryし、Input DNAは50 μL、Unbound DNAとChIP DNAは20 μLの1 x TEに溶解します。-20℃で保存。
4) PCR反応と定量化
■ PCRプライマーの設計
ヒストンのアセチル化はプロモーター領域等に限局して起こる可能性があるので、PCRプライマーはこの領域で設計します。PCRプライマーは20〜30 base、Tm値が55〜60℃に、PCRのtarget sizeは150〜250 bpに。PCRプライマーはInput DNAを用いて増幅効率や非特異的増幅がないことなどを確認しておきましょう。
■ ChIPのコントロール
免疫沈降のコントロールはnormal rabbit IgG等のコントロール抗体で取りましょう。
DNA組換え等が起こりDNA量が変化する場合には、Input DNAのコントロールが有効です。また、ChIP DNAとUnbound DNAのPCR産物の量比を比較する場合もあります。
ChIPのポジコンlocusは、GAPDHやHPRTなどのhouse keeping遺伝子を用いましょう(ただし、これらの遺伝子座はX染色体上にあるので、定量化した時に性差が生じてしまいます)。ネガコンlocusは 解析予定の細胞で発現されていない遺伝子を用いましょう(例えば、T細胞ではCD19を、B細胞ではCD3)。
■ PCRのコントロール
PCRプライマーによる反応効率の違いを補正するために、standard DNA(我々の場合にはBa/F3細胞のInput DNA)の3倍〜5倍の段階希釈列(50, 10, 2, 0.4, 0.08 ng等)をPCR反応のコントロールに置きます。これにより、異なるPCRプライマー間の結果を比較することが可能となります。Input DNA、ChIP DNAともに、この段階希釈列のうち定量性が保たれている範囲に入るように希釈が必要となることがあります。
| ■ PCR反応 | |
| H2O | 4.9 μL |
| 10 x PCR buffer | 1 μL |
| 2.5 mM each dNTP | 1 μL |
| 10 mM forward primer | 1 μL |
| 10 mM reverse primer | 1 μL |
| Input /ChIP DNA | 1 μL |
| Taq polymerase | 0.1 μL |
|
|
|
| total | 10 μL |
| PCRサイクルは、94℃ 3分 → (94℃ 20秒、55〜60℃ 1分、72℃ 1分+2秒 x サイクル数) x 25〜30サイクル、72℃ 10分、4℃。 | |
■ アガロースゲル電気泳動
5〜8 μLのPCR反応物を2%アガロースゲルにて電気泳動します。ゲルの写真をそのまま結果とするか、CCDカメラで取り込み画像解析ソフト(Fuji Film, Image Gauge等)でPCR産物を定量します。さらに定量性と特異性を高めるためには、サザン法にてバイオイメージアナライザーにて定量します。
■ Real-time PCR
TaqMan法あるいはSYBR greenを用いてreal-time PCRを行い、PCR産物を定量します。
プロトコールの注意点
※1 細胞数はあらかじめチェックしましょう。使用する抗体の数に応じて増減させます。抗体3種類の場合には、1〜2 x 106細胞程度で行います。転写因子に対する抗体の場合には、細胞数は多めにします。
※2 FACS solutionでも構いません。
※3 formaldehyde原液を直接メディウムに加えることもあります。アセチル化ヒストンの場合にはfinal 0.7〜1%で固定する。
※4 固定条件はあらかじめチェックします。固定時間・温度は、アセチル化ヒストンの場合で5分間室温、転写因子や転写共役因子の場合は5分間室温〜1時間4℃〜overnight 4℃となります。
※5 超音波細胞破砕装置の水槽をあらかじめ氷が浮かんだ水で満たし(氷を入れすぎない)、装置を冷やしておきましょう。超音波処理の強度はあらかじめチェック しておきます。Input DNAと同じ処理をした後にアガロースゲル電気泳動を行い、DNAの平均長が500 bp位になるようにしましょう。特に、大きなサイズのDNAが残らないことを確認します。また、固定時間を長くした時は、超音波処理の強度も強くする必要 があります。この場合には、DNAの平均長が1000 bpを越えることもあります。非密閉式の超音波細胞破砕装置を用いても可能ですが、この場合には容器などの工夫が必要です。
※6 抗体量は、S/N比が最大となるようにあらかじめtitrationしましょう。
※7 Protein G Sepharose®とProtein A Sepharose®の1:1 mixtureを用いることもあります。
※8 Sepharose®ビーズを除かないで処理すると回収率が上がります。
この技術情報は、生田 宏一先生1)、縣 保年先生2)よりご提供いただきました。
1) 京都大学ウイルス研究所 生体応答学研究部門 生体防御研究分野
2) 京都大学大学院医学研究科 先端領域融合医学研究機構























