タンパク質をプロテアーゼあるいは化学的な手段を用いて分解した混合物を、逆相クロマトグラフィーあるいは二次元電気泳動法(two- dimensional electrophoresis) によって分離し、そのパターンを解析することをペプチドマッピング(peptide mapping)といいます。
逆相クロマトグラフィーとは、固定相(充填剤)の極性を移動相(溶媒)よりも小さくして分離するクロマトグラフィーの一手法です。分離対象物(溶質)は疎水結合によって固定相に保持され、親水性の高い溶質ほど早く、逆に疎水性の大きな溶質ほど遅れて溶出します。分離用カラムとしては一般にシリカゲルを素材とした多孔性の担体が多く、その表面を炭化水素鎖で被っています。炭化水素の鎖長としては、炭素数が4個 (C4) から18個 (C18) まで各種あります。一般に低分子量で極性が低い物質の分離にはC18カラムなどが、高分子量の物質が対象の場合はC4カラムあるいはC8カラムがもっぱら用いられます。また、0.1%トリフルオロ酢酸(TFA)を含むアセトニトリル-水系が移動相としてよく用いられます。
クロマトグラフィーの分離能を上げるためには一般に粒子径が小さいほうが良いと言われています。しかしよく経験するように目詰まりが起き易くなり、流速が低下します。流速を維持するためには圧力をかけざるを得ず、その圧力に耐えうる材質のクロマトグラフィー担体と装置が開発されました。これがHPLC(high performance liquid chromatography)装置です(図6-1)。
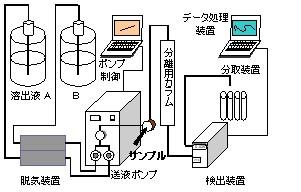
図6-1.一般的な高速液体クロマトグラフィー装置の模式図。実際にはポンプの制御とデータ処理は同一のコンピュータを使用しています。
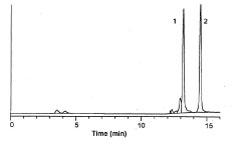
図6-2.ウシラクトフェリシンのジスルフィド結合を還元し、ピリジルエチル化した後に逆相クロマトグラフィーを行い、修飾されたペプチド(ピーク1)と、修飾されていないペプチド(ピーク2)を分離しました。カラムはTSKgel ODS-80Ts、210 nmで検出、流速は1 ml/min。溶出は0.1%TFA/アセトニトリル(0.1%TFA)の濃度勾配溶出法。
高圧グラジェント溶出法に用いるクロマトグラフィー装置は、溶媒を一定の流速で送液するポンプ(2台)、グラジェントコントローラ、サンプルインジェクター、分離用カラム、検出器、記録計あるいはデータ処理用コンピュータで構成されます。カラム恒温槽、オートサンプラー、フラクションコレクターなども用いられます。溶出する物質の検出方法としては、紫外部での吸光度を測定するのが一般的です。
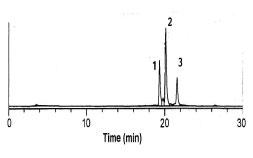
図6-3.ピリジルエチル化したウシラクトフェリシン(図6-2のピーク1)のCNBrによる開裂混合物の逆相クロマトグラフィーパターン。ピーク1、2はフラグメントで、ピーク3は未分解のもの。カラムはTSKgel ODS-120Tで、210 nmで検出。他の実験条件は図6-2と同じ。
第3章ではNローブに対するモノクローナル抗体を得るために、Nローブの一部であるラクトフェリシンを用いてマウスの免疫を行いました(第3章の補足cを参照)。そこで用いたペプチドを構成しているアミノ酸残基について、抗体との反応性への寄与を調べるために下記の実験を行いました。すなわちLys残基のε-アミノ基を無水コハク酸(succinic anhyd¬ride)で、Arg残基のグアニジル基を1,2-シクロヘキサンディオン(1,2-cyclohexane¬dione)で、Trp残基のインドール基をN-ブロモサクシンイミド(N-bromosuccin imide, NBS)でそれぞれ反応させました。次いで各反応混液から逆相クロマトグラフィーで目的の修飾ペプチドと未修飾ペプチドおよび過剰の試薬を分離しました。得られた修飾ペプチドについてELISA法でモノクローナル抗体との反応性を調べたところ、Lys残基を修飾したものでは残存反応性が96.5%でしたが、Arg残基とTrp残基を修飾した場合は、残存反応性がそれぞれ30%と28%に低下しました。このことより、抗体との反応にはArg残基とTrp残基が関与している可能性が大きいことが分かりました1)。
上記の反応以外にもアミノ酸残基側鎖の官能基を修飾する方法は多数あります。例えばLys残基のε-アミノ基はトリニトロベンゼンスルホン酸(TNBS)と反応し呈色するため、アミノ基の定量にも用いられています。また、CysHの-SH基のアルキル化には4-ビニルピリジン(4-vinylpyridine)によるピリジルエチル化が後述のアミノ酸配列決定の場合に使用される方法です。His残基側鎖のイミダゾール基の化学修飾はジエチルピロカーボネイト(DEPC)によって行いますが、これはリボヌクレアーゼの阻害剤でもあります。
タンパク質やペプチドの特定のアミノ酸側鎖に対する化学的な修飾は、そのタンパク質などの機能に関与している残基の同定、さらには機能発現のメカニズムなどについての情報を得るために行われます。また、対象としたアミノ酸残基がタンパク質分子の表面に露出しているか、あるいは内部に埋没しているかなどの知見を得ることも可能です。高次構造が知られている場合には、それらをつき合わせてより詳細な解析が可能となります。その他に、分子内あるいは分子間の架橋を行う場合にも化学的な方法が用いられます。酵素の安定性を高めたり、担体に固定したりする場合がその例です。また、[125I]-Bolton-Hunter試薬などによる放射性標識もアミノ基に対する修飾反応を利用しています。蛍光性物質を特定の部位に導入して、その分子の挙動や置かれた環境を知るためのプローブとして用いる場合もあります。
ペプチド鎖以外、たとえば糖鎖が抗原決定基となっている可能性もあり得るので、糖鎖を切り離したペプチド鎖を調製し、その抗原性を調べました。この操作によって糖鎖が除かれたことは、処理前後のペプチドのSDS-電気泳動による分離の際の移動度の変化と、泳動後のアクリルアミドゲル中で糖質を染色することができるPAS (periodic acid- Shiff) 染色法によって確認しました。その他に電気泳動後のゲルからタンパク質成分をニトロセルロース膜に転写した後に、酵素標識したレクチンで確認する方法もあります。あるいは、電気泳動をせずに直接にサンプルをニトロセルロース膜に吸着させて(ドットブロット法)、レクチンとの反応性を見る方法もあります2)。























