siRNAは、3’ 末端に2塩基のオーバーハングを持つ21〜23塩基の二本鎖RNAです。アニーリング処理された ready-to-use のsiRNAを利用することが一般的です。
◆ アニーリング済み二本鎖のsiRNAを購入する場合:弊社では専用のご注文書をご用意しています。
- siRNA配列指定: 通常、ターゲット遺伝子配列を指定します。
- 塩基数の指定: 21〜27塩基が一般的。
- オーバーハングの指定: RNAオリゴまたはRNA-DNAのキメラオリゴから選択。
- センス鎖とアンチセンス鎖間でミスマッチがある場合はポジションを明記します。
- 通常はアニーリングバッファーが含まれています(不要な場合は明記します)。
※2塩基のオーバーハングには、多くの場合チミン(TT)やウラシル(UU)が使用されます。もちろんその他のオーバーハングを使用した場合でもRNAi効果に大きな影響を与えるという報告はありません。しかし、siRNA末端を平滑にする、5’末端のみをオーバーハングにする、オーバーハングの長さを変えるといったことを行うとRNAi効果に影響を与える場合があります。
● Elbashir et al., EMBO J,20:6877-6888
siRNA配列指定の例
ターゲット遺伝子配列 : 5’ - CGGAAGATGAAGAGGAAGA - 3’
センス配列 :
アンチセンス配列 : |
5’ - CGGAAGUGAAGAGGAAAGATT - 3’
5’ - UCUUCCUCUUCAUCUUCCGTT - 3’ |
◆ 一本鎖RNAを購入する場合
一本鎖のRNAを購入し、ご自身でアニーリングすることもできます。
- RNAオリゴまたはRNA-DNAのキメラオリゴから選択
- 通常、RNAは糖鎖の 2’ に保護基がついた状態で合成されるために脱保護が必要
※ 2001年ころには、「ターゲット遺伝子のAAからはじまる19塩基に相補する配列」がRNAi効果が高いといった報告がありました (1,2,3)。そのため多くの研究者がAAから始まる19塩基をsiRNAのターゲット配列として使用し、文献上ではAA + 19塩基と記載されています。この文献情報をもとに、「AA + 19塩基 + 2延期のオーバーハング(合計23塩基)」の二本鎖 siRNAを合成すると、文献に紹介された配列とは異なる配列となってしまいますので注意が必要です。
(1)Nature , 411, 494-498, 2001
(2)EMBO J., 20, 6877-6888, 2001
(3)Genes Dev., 15, 188-200, 2001
si/shRNA配列および使用する発現ベクターが決定したら、次にサブクローニングサイトを決定します。一般に、pol III 系のプロモーターは転写開始がポジショニングや塩基配列(プリン塩基)に依存するといわれ、注意が必要です。
◆ 挿入配列のデザイン
下記のように、末端に制限酵素サイトをもたせた挿入配列をデザインすることが一般的です。
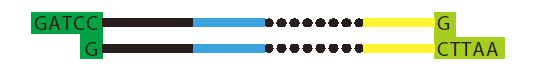
◆ DNAオリゴの入手
下記のような2本のオリゴを入手します。

アニーリングした後、ベクターのプロモーター下流にライゲーションします。サブクローニング後は、sequencing により配列確認を行います。
RNAi実験を行う際は、ネガティブコントロールsiRNAとポジティブコントロールsiRNAでの実験を並行して行います。ネガティブコントロールは実験に使用するすべての遺伝子配列と一致しないもの*1(すなわちRNAi効果のないもの)、ポジティブコントロールはあるターゲット遺伝子に対して優れたRNAi効果を示すことが実証されているものを使用します。これは、RNAiを誘導しようとする細胞のRNAi効果(RNAi効果の持続性や発現抑制効率)を事前に確認するためや、独立した実験ごとの再現性を確認するために使用します。なお、DNAプラスミドと合成siRNAのトランスフェクション至適条件は異なるので、合成siRNAに最適化する必要があります。
*1:下記の3種類のうちいずれかを使用することが一般的です。
(1)市販のコントロールsiRNA(ゲノム上に存在しない配列)
(2)RNAiを誘導する生物のゲノム上に存在しない遺伝子をターゲットするsiRNA
例 : 哺乳類細胞を利用する場合、ルシフェラーゼ遺伝子やGFP遺伝子を標的するsiRNA
(3)ターゲット遺伝子特異的なsiRNA配列をもとに、これをスクランブル(G, A, U, Cそれぞれのヌクレオチドの比率を変えずに配列だけをランダムに変更する)して、ゲノム上に存在しない配列にしたsiRNA