Rockland immunochemicals社では、Histone 研究のための抗体商品を多数取り揃えております。
Histone 抗体
ヒストンの修飾
ヒストンの機能は、DNAを核に収納するだけではありません。ヒストンは、アルギニンとリジンを多く含むため、塩基性の小さなタンパク質です。ヒストンは、19世紀末にドイツの生理学者 Albrecht Kossel によって初めて同定されました1。4つのコアヒストンH2A、H2B、H3、H4の各2コピーと、それらに巻き付いたDNAの組み合わせが、ヌクレオソームコア粒子と呼ばれるものを形成します。2つのヒストンH3/H4二量体が会合することにより、最初は安定した四量体が形成されます2,3。2つの単一ヒストンH2A/H2B二量体4が最終的にヒストン八量体を形成します。
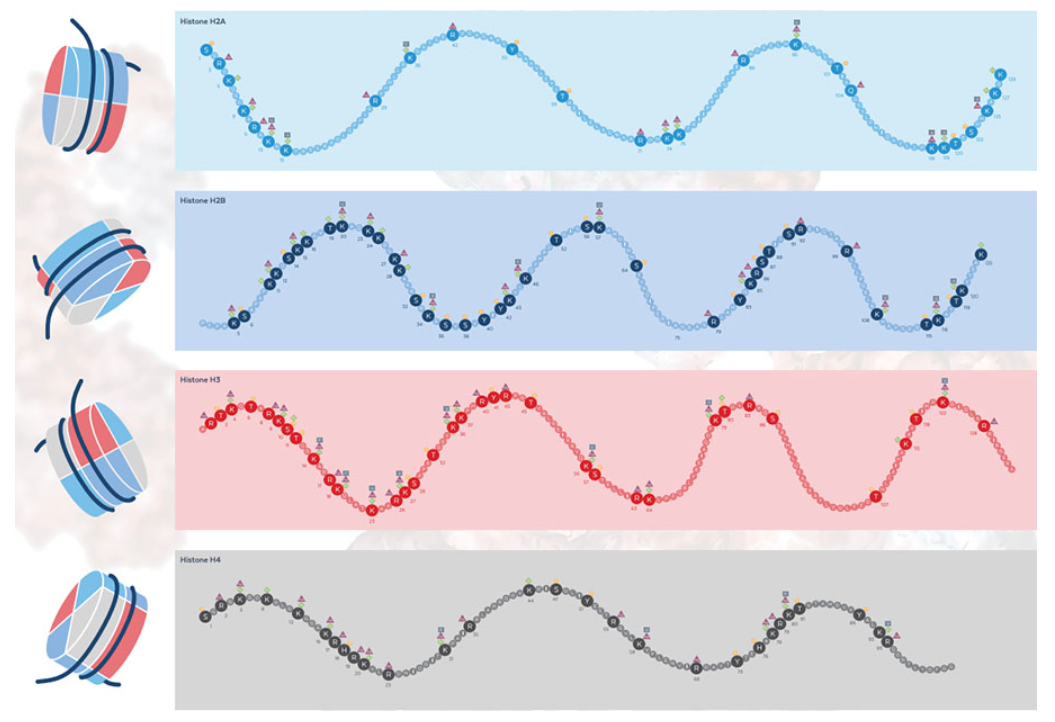
図1. ヒストン H2A、H2B、H3、H4 の翻訳後修飾の包括的なマップ
翻訳後修飾されたヒストンの最初の記述は、1960 年代半ばに行われました。メチル化リジンは子牛胸腺のヒストンの分析で検出され、その後すぐにアセチル化リジンも同定されました5,6。それ以来、アルギニンのメチル化、リン酸化、シトルリン化、ビオチン化、ユビキチン化、マロニル化、SUMO 化などの他の修飾がヒストンに関連付けられてきました7。ヒストンの特定のアミノ酸の共有結合修飾はヒストンコードを形成し8、これが時間的および空間的に分化したクロマチンドメインを確立するための基礎となります (例については上の図を参照)。
末端のヒストン領域の修飾で最もよく知られているものは、ヒストン H3のリジン9 (H3K9) のメチル化です。たとえば、哺乳類では、この修飾は、条件的または構成的ヘテロクロマチン、つまり一時的または永続的な遺伝子サイレンシングの領域を示します9,10。DNA メチル化と同様に、遺伝子発現の調節は DNA 配列とは無関係に受け継がれるため、H3K9 メチル化などのヒストン修飾は、エピジェネティクスの基礎となります。ヒストン修飾の機能に関するさらなる研究は、エピジェネティクスの理解を深めることになります。さらに、ヒストン修飾の変化は、がんを含む多くの疾患の病因に関与しています11。Rockland社の抗体ベースのツールは、世界中の科学者によって治療オプションの発見に使用されています。
商品ラインアップ
■汎特異的抗体 ■Histone H3 抗体 ■Histone H4 抗体 ■Histone H2A 抗体
汎特異的抗体
| Product | Clonality | Reactivity | Application |
|---|---|---|---|
| Lysine Acetylated Antibody | Polyclonal | Broad | WB, IP |
| Lysine Methylated Antibody | Polyclonal | Broad | WB |
| SUMO Antibody | Polyclonal | Broad | WB, ChIP, IP, ELISA |
| Ubiquitin Antibody | Polyclonal | Broad | WB, ELISA |
Histone H3 抗体
| Product | Clonality | Reactivity | Application |
|---|---|---|---|
| Histone H3 R2me1 Antibody | Polyclonal | Human, C. elegans | WB, Dot Blot |
| Histone H3 R2me2a Antibody | Polyclonal | Human, C. elegans | WB, IF, Dot Blot |
| Histone H3 R2me2s/K4me2 Antibody | Polyclonal | Human, Mouse, C. elegans | WB, IF, ChIP, Dot Blot |
| Histone H3 K4ac Antibody | Polyclonal | Human, Mouse, C. elegans | WB, IF, ChIP, Dot Blot |
| Histone H3 K4me1 Antibody | Polyclonal | Human | WB, Dot Blot, ELISA |
| Histone H3 K4me2 Antibody | Polyclonal | Human, C. elegans | WB, IF, ChIP, Dot Blot |
| Histone H3 K4me3 Antibody | Polyclonal | Human, Mouse, C. elegans | WB, IF, ChIP, Dot Blot |
| Histone H3 phospho T6 Antibody | Polyclonal | Human, C. elegans | WB, IF, Dot Blot |
| Histone H3 R8me2a Antibody | Polyclonal | Human, Mouse, C. elegans | WB, IHC, IF, ChIP, Dot Blot |
| Histone H3 R8me2s Antibody | Polyclonal | Human, C. elegans | WB, ChIP, Dot Blot |
| Histone H3 K9ac Antibody | Polyclonal | Human, Mouse, C. elegans | WB, IF, ChIP, Dot Blot |
| Histone H3 K9ac/K14ac Antibody | Polyclonal | Human, Mouse, C. elegans | WB, IF, Dot Blot |
| Histone H3 K9me1 Antibody | Polyclonal | Human, Mouse, C. elegans | WB, IF, ChIP, Dot Blot |
| Histone H3 K9me2 Antibody | Polyclonal | Human, C. elegans | WB, IF, ChIP, Dot Blot |
| Histone H3 K9me3 Antibody | Polyclonal | Human, C. elegans | WB, IF, ChIP, Dot Blot |
| Histone H3 phospho S10 Antibody | Polyclonal | Human, C. elegans | WB, IF, Dot Blot |
| Histone H3 phospho S10/pT11 Antibody | Polyclonal | Human, C. elegans | WB, IF |
| Histone H3 phospho T11 Antibody | Polyclonal | Human | WB, IF, Dot Blot |
| Histone H3 K18ac Antibody | Polyclonal | Human, Mouse, C. elegans | WB, IF, ChIP, Dot Blot |
| Histone H3 K18me1 Antibody | Polyclonal | Human, Mouse | WB, IF, Dot Blot |
| Histone H3 K18me2 Antibody | Polyclonal | Human, Mouse, C. elegans | WB, IF, ChIP, Dot Blot |
| Histone H3 K18me3 Antibody | Polyclonal | Human, Mouse | WB, IF |
| Histone H3 K23me2 Antibody | Polyclonal | Human, Mouse, Rat, C. elegans | WB, ELISA |
| Histone H3 K27ac Antibody | Polyclonal | Human, Mouse, C. elegans | WB, ChIP, Dot Blot |
| Histone H3 K27me1 Antibody | Polyclonal | Human | WB, IF, ChIP, Dot Blot, ELISA |
| Histone H3 K27me2 Antibody | Polyclonal | Human | WB, IF, ChIP, Dot Blot, ELISA |
| Histone H3 K27me3 Antibody | Polyclonal | Human, Mouse, Rat | WB, IF, Dot Blot |
| Histone H3 phospho S28 Antibody | Polyclonal | Human, Mouse | WB, IF |
| Histone H3 K36ac Antibody | Polyclonal | Human, C. elegans | WB, Dot Blot |
| Histone H3 K36me1 Antibody | Polyclonal | Human, C. elegans | WB, IF, Dot Blot |
| Histone H3 K36me2 Antibody | Polyclonal | Human, Mouse, C. elegans | WB, IF, ChIP, Dot Blot |
| Histone H3 K36me3 Antibody | Polyclonal | Human, Mouse, C. elegans | WB, IF, Dot Blot |
| Histone H3 K37me1 Antibody | Polyclonal | Human, Mouse, C. elegans | WB, IF, Dot Blot |
| Histone H3 K37me2 Antibody | Polyclonal | Human, Mouse, C. elegans | WB, IF, Dot Blot |
| Histone H3 K37me3 Antibody | Polyclonal | Human, C. elegans | WB, IF, Dot Blot |
| Histone H3 K56me1 Antibody | Polyclonal | Human, Mouse | WB, IF, Dot Blot |
| Histone H3 K56me3 Antibody | Polyclonal | Human, C. elegans | WB, IF, Dot Blot |
| Histone H3 K79me1 Antibody | Polyclonal | Human, Mouse, Monkey | WB, IF, ChIP, Dot Blot |
| Histone H3 K79me3 Antibody | Polyclonal | Human, C. elegans | WB, IF, ChIP, Dot Blot |
Histone H4 抗体
| Product | Clonality | Reactivity | Application |
|---|---|---|---|
| Histone H4 phospho S1 Antibody | Polyclonal | Human | WB, IF, ChIP, Dot Blot |
| Histone H4 R3me1 Antibody | Polyclonal | Human, Mouse | WB, IF |
| Histone H4 K5ac Antibody | Polyclonal | Human, Mouse | WB, IF, ChIP |
| Histone H4 K8ac Antibody | Polyclonal | Human, Mouse, C. elegans | WB, IF, ChIP, Dot Blot |
| Histone H4 K12ac Antibody | Polyclonal | Human | WB, IF, Dot Blot, Microarray |
| Histone H4 K16ac Antibody | Polyclonal | Human, Mouse | WB, IF, Dot Blot |
| Histone H4 K20me1 Antibody | Polyclonal | Human, Mouse, C. elegans | WB, IF, ChIP, Dot Blot |
| Histone H4 K20me2 Antibody | Polyclonal | Human, C. elegans | WB, IF, ChIP, Dot Blot |
Histone H2A 抗体
| Product | Clonality | Reactivity | Application |
|---|---|---|---|
| Histone H2A.Zac Antibody | Polyclonal | Broad | WB, IF, ChIP, Dot Blot, ELISA |
| Histone H2AvD phosphoS137 Antibody | Polyclonal | D. melanogaster | WB, IHC, IF, EM, ELISA |
| H2AX phospho S139 Antibody | Polyclonal | Human | WB, ELISA |
- Kossel, A., Über einen peptoartigen Bestandteil des Zellkern. Z. Physiol. Chem. 1884, 8, 511-515.
- Kornberg, R. D., & Thomas, J. O. (1974). Chromatin structure; oligomers of the histones. Science (New York, N.Y.), 184(4139), 865-868.
- Roark, D. E., Geoghegan, T. E., & Keller, G. H. (1974). A two-subunit histone complex from calf thymus. Biochemical and biophysical research communications, 59(2), 542-547.
- Kelley R. I. (1973). Isolation of a histone IIb1-IIb2 complex. Biochemical and biophysical research communications, 54(4), 1588-1594.
- ALLFREY, V. G., FAULKNER, R., & MIRSKY, A. E. (1964). ACETYLATION AND METHYLATION OF HISTONES AND THEIR POSSIBLE ROLE IN THE REGULATION OF RNA SYNTHESIS. Proceedings of the National Academy of Sciences of the United States of America, 51(5), 786-794.
- MURRAY K. (1964). THE OCCURRENCE OF EPSILON-N-METHYL LYSINE IN HISTONES. Biochemistry, 3, 10-15.
- Zhao Y, Garcia BA. Comprehensive Catalog of Currently Documented Histone Modifications. Cold Spring Harb Perspect Biol. 2015;7(9):a025064.
- Strahl, B. D., & Allis, C. D. (2000). The language of covalent histone modifications. Nature, 403(6765), 41-45.
- Rice, J. C., Briggs, S. D., Ueberheide, B., Barber, C. M., Shabanowitz, J., Hunt, D. F., Shinkai, Y., & Allis, C. D. (2003). Histone methyltransferases direct different degrees of methylation to define distinct chromatin domains. Molecular cell, 12(6), 1591-1598.
- Wu, R., Terry, A. V., Singh, P. B., & Gilbert, D. M. (2005). Differential subnuclear localization and replication timing of histone H3 lysine 9 methylation states. Molecular biology of the cell, 16(6), 2872-2881.
- Audia JE, Campbell RM. Histone Modifications and Cancer. Cold Spring Harb Perspect Biol. 2016;8(4):a019521.
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する