エピジェネティクス epigenetics 総説 総説:エピジェネティクス epigenetics ‐ ヒストン修飾とクロマチン構造変換による転写−
- カテゴリから探す > 特集 > 研究分野
- 研究分野から探す > エピジェネティクス > エピジェネティクス特集
- 研究分野から探す > がん研究 > エピジェネティクス解析
京都大学ウイルス研究所 生体応答学研究部門 生体防御研究分野
教授 生田 宏一
細胞が遺伝情報を発現する際には、脊椎動物の免疫システムなどの少数の例外を除き、塩基配列の変化を伴いません。しかしながら、例えば肝細胞は分裂後も肝細胞であるように、個々の細胞は分裂後もそれぞれの特性を保っています。このような遺伝子配列の変化を伴わない情報記憶と発現のメカニズムがエピジェネティクスであり、発生や分化など多様な生命現象に関係します。例えば、DNAのメチル化が遺伝子のサイレンシングと関係することは古くから知られています。特に近年、アセチル化などのヒストンの修飾とその機能の解析が飛躍的に進展しました。これに一役買ったのが、クロマチン免疫沈降法という実験方法です。一方、DNAメチル化やヒストンの修飾以外にも、クロマチン構造の形成とリモデリング、転写因子のネットワークもエピジェネティクスを担う機構と考えられます。最近ではそればかりではなく、RNAi と関係する small RNA がヒストンメチル化を介してヘテロクロマチン形成を誘導することが示されていまして、この研究領域からはますます目が離せなくなっています。
ヒストンの修飾
真核生物の染色体DNAはクロマチンとよばれる高次構造をとっています。クロマチンは、ヌクレオソームの繰り返し構造がらせん状につながったものです。ヌクレオソームは、H2A、H2B、H3、H4ヒストンタンパク質が2分子からなるヒストンオクタマーに、146塩基対のDNAが約2回転巻き付いた構造をとっています。
ヒストンはリジンなどの塩基性アミノ酸を多数もつタンパク質で、酸性であるDNAと堅く結合しています。ヒストンのN末端はヒストンテールとよばれ、ヌクレオソームコアから少し離れて存在しています。ヒストンは主にこのN末端の部分で様々な修飾を受けます。
近年、転写誘導の際に、ヒストン修飾によるクロマチン構造変換が重要な働きをすることが知られてきています(図1)。まず、DNA結合性転写活性化因子が標的遺伝子に結合すると、PCAFやCBP/p300などの転写コアクチベーターがリクルートされます。転写コアクチベーターはヒストンアセチル化酵素 (histone acetyl transferase: HAT)活性をもっており、周辺のヒストンをアセチル化します。これが引き金となりクロマチン・リモデリング因子がリクルートされ、クロマチンのリモデリングが誘導され、基本転写因子とRNAポリメラーゼによる転写が開始します。特に転写誘導とよく相関するアセチル化として、ヒストンH3K9とK14のアセチル化が知られています(図2)。ヒストンのリジン残基のアミノ基がアセチル化されると、アミノ基の正電荷が中和され、ヌクレオソーム間の相互作用が緩むと考えられています。
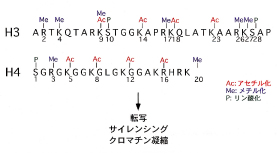
さらに、ヒストンはアセチル化以外にもメチル化やリン酸化などの修飾を受け、転写の制御・サイレンシング・クロマチン凝縮などを引き起こすことが知られています。どのヒストンのどのアミノ酸がどのような修飾を受けているか、さらにその組み合わせが一種の暗号のようになり、様々な細胞機能が発揮されると考えられています。このような考え方を、ヒストン暗号仮説あるいはヒストン暗号モデルとよんでいます(図2)。
ヒストンを修飾する酵素としては、上に挙げたHAT以外に脱アセチル化を触媒するヒストン脱アセチル化酵素(histonedeacetylase: HDAC)があります。細胞内ではHDACの活性が優位であり、クロマチンは通常脱アセチル化状態に保たれており、転写因子の働きで必要な時だけアセチル化され、開くと考えられます。
ヒストンのメチル化は、ヒストンメチル化酵素(histonemethyltransferase: HMT)によって誘導されます。現在、よく解析されているのはヒストンH3K9のメチル化です。メチル化されたK9を HP1(heterochromatin protein 1)が認識して結合します。HP1はDNAメチル化酵素やHDACをリクルートし、またHP1同士が集合化することにより、周辺クロマチン領域を閉じた状態に変換します。このような機構により、遺伝子座のサイレンシングが起こることが知られています。一方、ヒストンH3K4のメチル化は、転写の活性化と相関することが知られています。
一般に、逆の脱メチル化反応は非常に起こりにくいと考えられています。現在までのところ、ヒストンの脱メチル化酵素は報告されていません。未知の脱メチル化酵素が関与しているのか、あるいは修飾部位を含むヒストンのN末端部分がタンパク分解酵素によって切断されることで除去されるのか、今後の研究が待たれます。
ヒストンにはアセチル化とメチル化以外にも様々な修飾を受けることが知られています。リン酸化は細胞分裂時の染色体の凝縮と関係し、ユビキチン化は転写の活性化と、SUMO化は転写の抑制と関係しています。さらに、ADPリボシル化やビオチン化など、その機能がよくわかっていないものもあります。今後、この領域の研究がさらに進み、精巧な制御機構が明らかになる日は遠くないと思います。
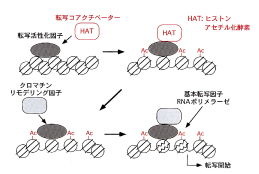 |
【図1】 ヒストンアセチル化による転写誘導 DNA結合性転写活性化因子が標的遺伝子に結合すると、転写コアクチベーターがリクルートされる。転写コアクチベーターはヒストンアセチル化酵素活性をもっており、周辺のヒストンをアセチル化する。これが引き金となりクロマチン・リモデリング因子がリクルートされ、クロマチンのリモデリングが誘導され、基本転写因子とRNAポリメラーゼによる転写が開始する。 |
| 【図2】 ヒストン修飾とその機能:ヒストン暗号仮説 ヒストンのN末端の様々なアミノ酸残基はアセチル化・メチル化・リン酸化の修飾を受ける。それぞれの修飾は別個の分子により認識され、転写の制御・サイレンシング・クロマチン凝縮などを引き起こす。 |
 |
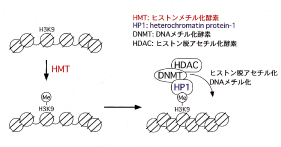 |
【図3】 ヒストンH3 Lys9残基のメチル化と遺伝子座のサイレンシング ヒストンH3 Lys9(K9)残基がヒストンメチル化酵素によりメチル化されるとHP1タンパク質がリクルートされる。HP1はさらにDNAメチル基転移酵素やヒストン脱アセチル化酵素をリクルートし、ヘテロクロマチン化と遺伝子座のサイレンシングが誘導される。 |
クロマチン免疫沈降(ChIP)
本稿に続き詳しいクロマチン免疫沈降法(chromatin immunoprecipitation: ChIP)のプロトコールが述べられています。ChIPとは、ホルマリンでDNAとヒストンなどのDNA結合タンパク質を架橋した後、超音波処理により可溶性のクロマチンにし、これ をアセチル化ヒストンや転写因子に対する抗体で免疫沈降するものです。免疫沈降物からDNAを精製し、PCR法にて目的とするDNA領域がどれだけ濃縮されているかを解析します。これにより、内在性のクロマチン領域にどれだけアセチル化されたヒストンや転写因子が結合しているかを調べることができます。ChIPは、このような利点からレポーター法やゲルシフト法と並んで、転写制御機構の解析において非常にポピュラーな方法となっています。
ChIPの実験においては、複数のサンプルを並行して処理する必要があることから、私達の研究室ではコスモバイオ社の密閉式超音波細胞破砕装置(Bioruptor)を使用しています。これは1.5Fチューブのキャップを閉じたまま同時に6〜24本処理できるという特徴をもっています。ChIPプロトコールの主な注意点としては、細胞の固定の条件、超音波処理の条件、抗体の選択、PCRのコントロール設定と定量化、などが挙げられます。いずれも簡単な条件検討でコントロールできます。
DNAのメチル化
多くの真核生物ではゲノム中のCpGジヌクレオチドのシトシンの5位炭素原子にメチル基が付加されます。ゲノム中のCpGジヌクレオチドの60〜90%がメチル化を受けていますが、多くの遺伝子のプロモーター領域にあるCGの豊富な領域(CpGアイランド)ではメチル化を受けていません。この例外として、インプリンティングされる遺伝子や女性の不活化X染色体ではCpGアイランドがメチル化され、転写が不活化されています。また、癌細胞では癌抑制遺伝子のプロモーター領域でCpGがメチル化されていることが報告されています。
CpGアイランド以外ではCpGは強くメチル化されています。メチル化CpGは、反復配列を多く含むヘテロクロマチンやトランスポゾンにみられており、ウイルスやトランスポゾンの活性化を抑えていると考えられます。
哺乳類では5種類のDNAメチル化酵素遺伝子が単離されていますが、そのうちメチル化酵素活性が認められているのは、Dnmt1、Dnmt3a、Dnmt3bの3つです。Dnmt1はDNA合成期のメチル化の維持にかかわるもので、Dnmt3aは胚盤胞期以降のde novoメチル化を起こし、Dnmt3bはインプリンティング遺伝子のメチル化を起こします。一方、脱メチル化は純粋な逆反応が起こらないので、5-メチルシトシンDNAグリコシラーゼによりメチルシトシンが除去され、DNA修復酵素によってシトシンに置き換えられます。
メチル化CpGに結合するタンパク質として、MeCP2、MBD1、MBD2、MBD3などが知られています。これらがメチル化CpGに結合すると、HDACや転写コリプレッサーのSin3aと複合体を形成し、ヒストンの脱アセチル化や転写の抑制が協調して起こります。また、ヒストンのメチル化のところでも述べましたが、ヒストンH3K9のメチル化が引き金になりDNAメチル化酵素がリクルートされ、DNAのメチル化が誘導されることもわかっています。このように、エピジェネティクスを担ういくつかの機構は、相互に協調し複雑なクロマチンの制御を行っています。
small RNAによるヘテロクロマチンの形成
RNAi(RNA interference)は、2本鎖RNAで誘起される塩基配列特異的な遺伝子発現抑制です。2本鎖RNAはDicerとよばれるRNA?様酵素により分解されて約22塩基の短いRNAになります。このsmall RNAとArgonauteタンパクを取り込んだRISC(RNA-induced silencing complex)とよばれる複合体が、標的のmRNAを分解します。この分子機構は、動物だけではなく、植物では転写後遺伝子サイレンシング、アカパンカビではquellingとよばれる現象をおこします。また、mRNAを分解するだけではなく、mRNAと結合してタンパク質への翻訳をブロックして、発現を抑制する場合もあります。
このsmall RNAが未知の機構により標的クロマチンにHMTやHDACをリクルートし、ヒストンH3K9のメチル化とヒストンの脱アセチル化を誘導します。さらに、ヒストンH3K9のメチル化が引き金となり、クロマチン領域のサイレンシングが誘導されます。例えば、分裂酵母ではRNAi関連遺伝子を欠失すると、セントロメア領域で正常なヘテロクロマチン構造を維持することができません。また、接合型領域では新規ヘテロクロマチンの形成が障害されます。別の例として、Xist RNAによるX染色体不活性化があります。Xist RNAはX染色体不活化の開始に必要であり、X染色体全体を不活化する過程でXist RNAとヒストンH3K9のメチル化がほぼ同時に拡張します。また、テトラヒメナのゲノム再編成にもsmall RNAが関与しています。このようなsmall RNA→ヒストン修飾→DNAメチル化という経路が、他の生物にも保存されている可能性は十分にあります。
ヘテロクロマチンの主要な構成成分は反復配列であり、その多くはトランスポゾンから派生したと考えられます。また、RNAi類似の反応がトランスポゾンの転写抑制に関与しています。RNAi装置により誘起されるヘテロクロマチン形成や、テトラヒメナのゲノム再編成も、トランスポゾンに対する防御から進化したものかもしれません。脊椎動物における免疫システムが、トランスポゾンに由来するDNA組換え系を逆手に利用することにより進化したのとよく似ています。このようなゲノムの相克という観点からクロマチン構造変換をながめるのも興味深いものです。
免疫学におけるエピジェネティクス研究
私達の研究室では、インターロイキン7レセプター(IL-7R)によるT細胞抗原受容体(T cell antigen receptor; TCR)γ遺伝子座のDNA組換えの制御機構について研究をしています。リンパ球抗原受容体遺伝子座は分化段階特異的にV(D)J組換えをおこしますが、これはクロマチン構造変換により制御されています。私達の研究から、IL-7Rにより活性化されたSTAT5が、TCRγ遺伝子座に転写コアクチベーターをリクルートし、ヒストンのアセチル化を誘導し、クロマチンを開いた状態にすることが明らかになりました。この状態は、転写酵素とDNA組換え酵素に対してaccessibleになっていまして、転写とDNA組換えが誘導されると考えられます。IL-7RによるTCRγ遺伝子座の組換え制御システムは、V(D)J組換えにおいて細胞表面からクロマチンまでその制御機構が明らかとなった唯一の系で、免疫学におけるエピジェネティクス研究のモデル系となると考えられます。
Profile
生田 宏一 先生
(いくた こういち)

1987年京都大学大学院医学研究科博士課程修了。87年熊本大学助手、88年スタンフォード大学医学部博士研究員、92年東京大学医学部客員助教授を経て、96年より京都大学医学研究科助教授、2002年より現職の京都大学ウイルス研究所教授。IL-7レセプターシグナルを切り口として、造血幹細胞からのT細胞の初期分化機構の解明に迫りたいと思っていらっしゃいます。趣味は、読書、山歩き、鴨川べりのジョギングなどで、最近では“生命と免疫系の進化”に興味をもっていらっしゃるとのこと。
大学院生・ポスドク募集中 (生田研究室のホームページ ![]() )
)
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について
- 「総説:エピジェネティクス epigenetics ‐ ヒストン修飾とクロマチン構造変換による転写−」は、下記のカテゴリーに属しています。
-
- カテゴリから探す > 特集 > 研究分野
- 研究分野から探す > エピジェネティクス > エピジェネティクス特集
- 研究分野から探す > がん研究 > エピジェネティクス解析























 このページを印刷する
このページを印刷する












