ユビキチン※1 は全ての真核生物に存在する 76 アミノ酸からなる小さなタンパク質です。ユビキチン化活性化酵素 (E1)・ユビキチン結合酵素 (E2)・ユビキチンリガーゼ(連結酵素:E3)の3 種類の酵素群の働きにより、ユビキチンは標的タンパク質分子(基質)に共有結合(アミド結合)し、多くの場合、ユビキチンにさらにユビキチンが鎖状に連なる「ユビキチン鎖」が形成されます。ユビキチン鎖を目印としたプロテアソームに※2 よる選択的分解系「ユビキチン−プロテアソーム系」は、細胞内で役割を終えた不要なタンパク質や異常タンパク質を速やかに消去させる役割を担っています。このタンパク質分解系は、正しい細胞周期の進行や細胞内の恒常性の維持に寄与しているため、この系に異常が生じると、神経変性疾患※3 やがんなどの原因となることが知られています。また、最近では、ユビキチン鎖は細胞内の情報伝達系・損傷 DNAの修復や細胞表層にある膜タンパク質の細胞内への取り込みの信号として働くことなども次々と明らかとなり、非常に多様な生命現象の制御に関わることが分かってきています。
どのタンパク質にどのタイミングでユビキチン鎖をつけるのか、その「基質の選択性」を決めているのは「ユビキチンリガーゼ(連結酵素:E3)」です。ユビキチンリガーゼはヒトではおよそ 600 種類ありますが、その基質が明らかとなっているものはごくわずかです。ユビキチンリガーゼの基質を網羅的かつ高感度に探索できる技術の開発は、広範な生命現象の制御に関わるユビキチン化を理解する上でも重要であると考えられます。
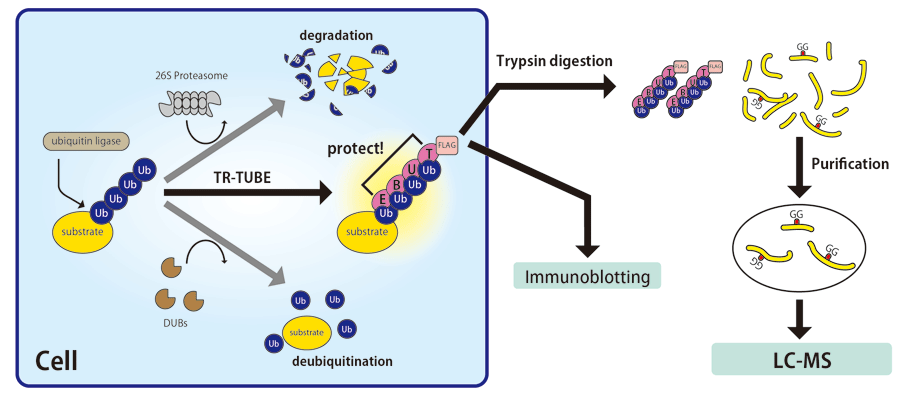
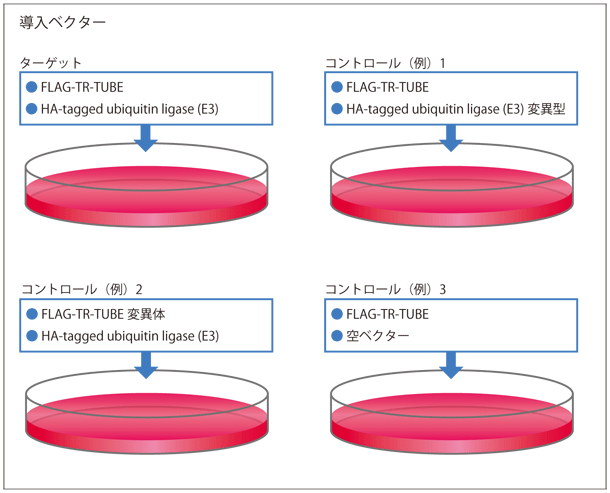
ユビキチン化タンパク質は多くの場合、プロテアソームにより分解されてしまうために細胞内に存在量が少ないか、また、分解を受けない場合でも、細胞内に存在する脱ユビキチン化酵素 (DUBs)※4 によりユビキチン鎖がはずされてしまうため、ユビキチン鎖が付いた状態で細胞内に存在する量は極わずかです(図1)。そのため、一般的にプロテアソームや脱ユビキチン化酵素の阻害剤で細胞を処理しますが、過剰発現させたユビキチンリガーゼの基質を優先的に安定に保つことは困難であり、さまざまな方法が試されてきましたが、決め手となる方法はありませんでした。
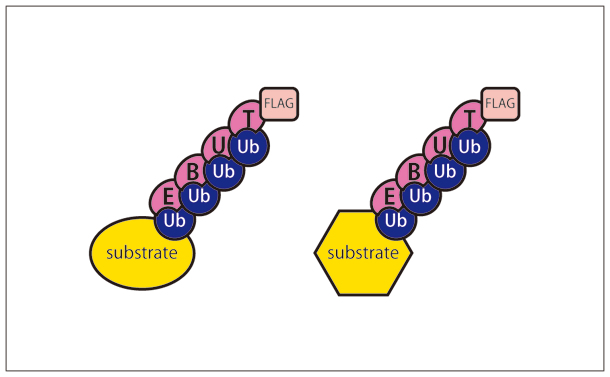
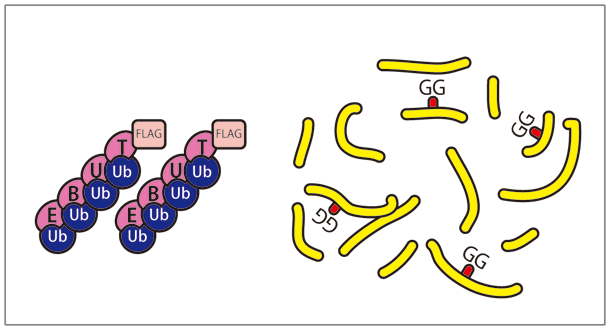
今回開発した TR-TUBE※5 (図2)というユビキチン鎖結合プローブを目的のユビキチンリガーゼと共に細胞内に発現させる方法は、そのブレークスルーとなるプロトコールです。TR-TUBE が脱ユビキチン化酵素やプロテアソームから基質についたユビキチン鎖を保護するため、ユビキチン鎖が結合したままの基質を優先的に細胞内に保つことができます(図1)。さらに、このプローブを利用して、ユビキチン鎖が結合した基質を濃縮することができました。そして、最近開発された、質量分析を用いたプロテオーム解析※6 を行う際に生じる特異的な配列を認識する diGly 抗体※7 と組み合わせることにより、効率よく目的とする基質の同定を行うことが可能となりました。この同定法を多くの研究者に利用してもらうことにより、新たな生命現象の理解、さらには、さまざまな疾患の発症機構の解明につながることが期待されます。
*本商品は(公財)東京都医学総合研究所の吉田雪子主席研究員、佐伯泰副参事研究員、田中啓二所長らの研究成果によるものです。
*TR-TUBEの特許出願中。特許出願番号:日本(特願JP2015-547782)、米国(15/035357)、欧州(14863005.6)
(公益財団法人 東京都医学総合研究所のHPより引用)
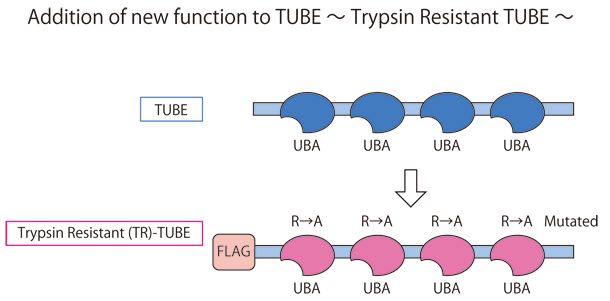
図2 TR-TUBE プローブ
用語説明
- ※1 ユビキチン:
至る所にある(ユビキタス)ことに由来するタンパク質の名前。進化的な保存性が高く、全ての真核生物に存在する76個のアミノ酸配列を持っています。ユビキチンはさまざまなタンパク質のリジン残基に共有結合(アミド結合)し、多くの場合ユビキチンにさらにユビキチンが連なる「ユビキチン鎖」が形成されます。ユビキチン鎖は、細胞内で役割を終えた不要なタンパク質や異常タンパク質を速やかに消去するための「タンパク質分解の目印」となります。また、タンパク質分解の目印となるばかりではなく、細胞内の情報伝達系・損傷 DNA の修復や細胞表層にある膜タンパク質の細胞内への取り込みの信号として働くなど、多様な生命現象の制御 に関わることも分かってきています。「タンパク質のユビキチン化」に異常が生じると、神経変性疾患やがんなどの原因となることが知られています。






















 このページを印刷する
このページを印刷する

![[注意]](/product/cell/detail_images/ico_caution_s.png) 企業のお客様でご購入希望の方におかれましては、恐れ入りますが別途ライセンス料がかかります。
企業のお客様でご購入希望の方におかれましては、恐れ入りますが別途ライセンス料がかかります。












