AAT Bioquest社が開発したTransfectamine™トランスフェクション試薬は、真核細胞に外来性核酸を導入するために設計されたカチオン性脂質トランスフェクション試薬です。(表1)
表1.カチオン性脂質トランスフェクション法の概要
| 原理 | |
|---|---|
| 負電荷を帯びたヌクレオチドがカチオン性脂質と複合体を形成し、 細胞膜を通過してエンドサイトーシスによりヌクレオチドを細胞質に放出する。 |
|
| メリット | デメリット |
| ・使いやすく、最小限のステップ数 ・高いトランスフェクション効率 ・多様な真核細胞に対応 ・解離した細胞やスライスに効果的 ・パッケージサイズの制限なし |
・特定の細胞を標的にするのが難しい ・すべての細胞種に適用できるわけではない ・ほとんどの初代細胞でトランスフェクション効率が低い |
Transfectamine™トランスフェクション試薬は、優れたトランスフェクション性能と汎用性を備えており、様々なペイロードを様々な接着細胞株および浮遊細胞株に効果的にトランスフェクションすることができ、優れた効率、細胞生存率、そして再現性を実現します。
今回、AAT Bioquest社のTransfectamine™シリーズに、mRNA、siRNA、CRISPR/Cas9コンポーネントなど、複数のペイロードタイプに対応するオプションが追加されました。
Transfectamine™ 6000 CRISPR
プラスミド、リボ核タンパク質(RNP)、mRNAを含む様々なCRISPR/Cas9システムをサポートします。
Transfectamine™ 7000 siRNA
低分子干渉RNA(siRNA)およびマイクロRNA(miRNA)を多様な細胞種に効率的に送達します。
表2.Transfectamine™シリーズ
| 品名 | 細胞種 | 接着性または浮遊性 | ペイロード | 導入方法 | サイズ | 品番 |
|---|---|---|---|---|---|---|
| Transfectamine™ 5000 | HeLa細胞 遺伝子導入が難しい細胞 初代培養細胞 幹細胞 神経細胞 がん細胞 |
接着性 浮遊性 |
DNA プラスミド DNA mRNA RNA干渉(RNAi) コトランスフェクション |
In vitro | 50 µL 0.5 mL 1 mL 5 mL |
60019 60020 60021 60022 |
| Transfectamine™ 6000 CRISPR | HeLa細胞 初代培養細胞 幹細胞 神経細胞 がん細胞 |
接着性 浮遊性 |
mRNA プラスミドDNA リボ核タンパク質 (RNPs) |
In vitro | 50 µL 1 mL 5 mL |
60028 60023 60024 |
| Transfectamine™ 7000 siRNA | HeLa細胞 初代培養細胞 幹細胞 神経細胞 がん細胞 |
接着性 浮遊性 |
低分子干渉RNA (siRNA) マイクロRNA (miRNA) リボ核タンパク質 (RNPs) |
In vitro | 50 µL 1 mL 5 mL |
60027 60025 60026 |
| Transfectamine™ mRNA | HeLa細胞 初代培養細胞 幹細胞 神経細胞 がん細胞 |
接着性 浮遊性 |
mRNA | In vitro | 50 µL 500 µL 5 mL |
60029 60030 60031 |
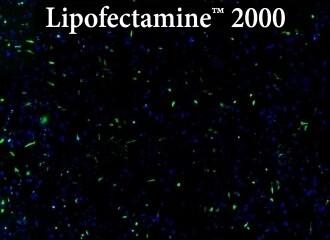
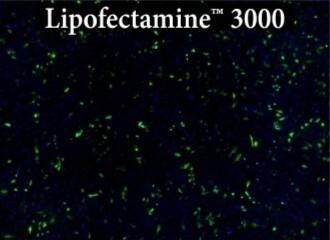
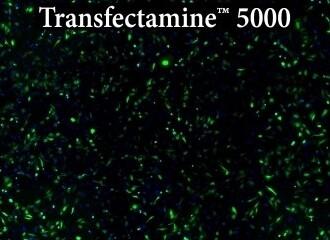
図.Transfectamine™ 5000、他社商品A、他社商品Bを用いたHeLa細胞へのトランスフェクション効率の比較
各試薬を用いて96ウェルフォーマットでHeLa細胞にトランスフェクションを行い、トランスフェクション後24時間でGFP発現を解析した。Transfectamine™ 5000トランスフェクション試薬は、他社商品Aおよび他社商品Bと比較して、より高いGFPトランスフェクション効率を示した。























 このページを印刷する
このページを印刷する














