
|
西田 奈央 先生 国立がん研究センター研究所 分子細胞治療研究分野 |
抗エクソソーム抗体を使用した
エクソソームの免疫電子顕微鏡法による観察例
ユーザーレポート
Products
- Anti CD9 for Exosome Isolation, Human (Mouse) Unlabeled, 12A12(品番:SHI-EXO-M01)
- Anti CD63 for Exosome Isolation, Human (Mouse) Unlabeled, 8A12(品番:SHI-EXO-M02)
メーカー:コスモ・バイオ株式会社

■ エクソソーム単離用モノクローナル抗体 Anti CD9, CD63, CD81
本製品はエクソソームマーカーとして知られているCD9, CD63, CD81を特異的に認識する抗体で、血清、培養上清から免疫沈降法を用いて、エクソソームを単離することが出来る抗体です。
- エクソソーム膜タンパク質CD9, CD63, CD81を高い特異性で認識
- エクソソーム表面抗原タンパク、内在性RNA(miRNA)、タンパク質解析に有用
実験内容
エクソソームは直径100 nm ほどの脂質二重膜の小胞であり、がん細胞はエクソソームを細胞外に分泌して周囲の細胞に悪影響を与え、がんの浸潤や転移を促進する。ならば、がん細胞由来のエクソソームの機能を阻害すれば、がんの転移が抑えられるのではないか?そこで私たちはエクソソームに結合する抗体を用いて、がん細胞由来のエクソソームの作用を阻害し、がんの転移を抑制することを目的に実験を開始した。
今回はヒト乳がん細胞を移植したマウスを転移モデルとして用い、ヒト乳がん細胞由来のエクソソームを認識するための抗体として、抗ヒトCD9 抗体(clone 12A12) および抗ヒトCD63抗体(clone 8A12) をこのマウスモデルに投与することにした。まず、乳がん細胞から単離してきたエクソソームの表面に抗体が結合することを確認しなければならない。エクソソームは直径100 nm の小胞なので、通常の顕微鏡の倍率では観察できず、電子顕微鏡を使用する必要がある。エクソソームに抗体が結合しているのを確認する術は他にもあるが、百聞は一見に如かず。抗体がエクソソームに結合しているかどうか、免疫電子顕微鏡で直接観察することにした。
しかし免疫電子顕微鏡は様々な条件検討が必要で、確実に標的の分子に結合するという抗体でないと試しにくい。これらの抗体は免疫沈降法に使用できる実績があり、エクソソーム表面のCD9、CD63 に結合することが分かっていたので試しやすかった。実際にはCD63 はすんなりと検出できたものの、CD9 のほうはなかなか検出できなかった。様々な条件の変更を経て、ようやく検出することができた(図1)。
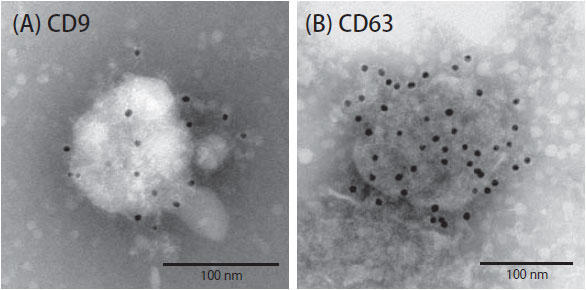
図1. 免疫電子顕微鏡によるエクソソーム表面のヒトCD9、CD63 タンパク質の検出例
(A) 抗ヒトCD9 抗体(clone 12A12) を用いて、ヒト乳がん細胞由来のエクソソームの表面に存在するCD9 の検出を行った。(B) 抗ヒトCD63 抗体(clone 8A12) を用いて、ヒト乳がん細胞由来のエクソソームの表面に存在するCD63 の検出を行った。
また、今回の実験の目的では、マウスとヒトの種特異性が大変重要になる。マウスに投与した抗体が、ヒトがん細胞由来のCD9、CD63 だけでなくマウス体内のCD9、CD63 にも結合すれば、毒性があることが容易に予想できるからである。これらの抗体は種特異性が大変高く、ウェスタンブロット法ではヒト由来のCD9、CD63 を容易に検出できたが、マウス由来のCD9、CD63 は、超高感度の検出試薬を使用してもほぼシグナルを検出できなかった(図2)。そのためか、マウスにヒトCD9、CD63 抗体を投与しても明確な毒性は見られず、抗体投与実験を進めることができた。
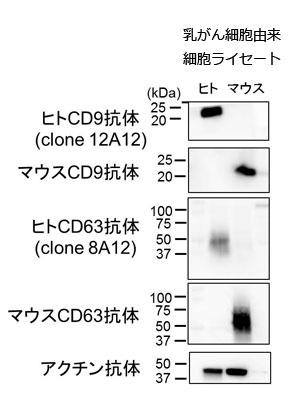
図2. ウェスタンブロットによるCD9、CD63 タンパク質の検出例
抗ヒトCD9 抗体(clone 12A12)、抗ヒトCD63 抗 体(clone 8A12)、抗マウスCD9 抗体、抗マウスCD63 抗体を用いて、ヒト乳がん細胞株(MDA-MB-231-D3H2LN) およびマウス乳がん細胞株(4T1-luc) 由来の細胞ライセートから、CD9、CD63 の検出を行った。
以上の結果から、これらの抗体が乳がん細胞由来のエクソソームに特異的に結合するという確信を得て、抗体を乳がんのモデルマウスに投与し、狙い通り実際にがんの転移を抑制することができた(1)。今回の実験の成功は、ひとえに高品質の抗体によるところが大きいと考えている。この抗体が、より多くの人の研究に役立つことを願っている。
製品使用文献
- Nishida-Aoki, N., N. Tominaga, F. Takeshita, H. Sonoda, Y. Yoshioka, and T. Ochiya. 2017. 'Disruption of Circulating Extracellular Vesicles as a Novel Therapeutic Strategy against Cancer Metastasis', Mol Ther, 25: 181-91.























 このページを印刷する
このページを印刷する