タンパク質は適切な緩衝液条件が維持されない場合、不溶性になるか不適切に機能する可能性があります。さらに、最適ではない緩衝液条件、分解、凝集の結果、活性を失う可能性さえあります。ラボでは、精製タンパク質は通常長期間保存する必要があり、その本来の活性と構造的完全性を保持する必要があります。
タンパク質の安定性は、数日から1年以上の間に変化する可能性があり、それはタンパク質の性質と保存条件によって異なり、最適条件は各タンパク質により異なります。
タンパク質やモノクローナル抗体が通常4℃の溶液に保存される場合、無菌状態に保たれているか、微生物やタンパク質の分解を防ぐために添加物を含んでいる必要があります。0.1%アジ化ナトリウム(NaN3)や0.01%チメロサールなどの抗菌剤は、微生物の増殖を抑制します。1〜5 mM EDTAなどの金属キレート剤は、金属が誘導する-SH基の酸化を防ぎ、タンパク質を還元状態に維持するのに役立ちます。1〜5mMの還元剤ジチオトレイトール(DTT)は、システイン残基間の分子内および分子間結合の形成を防止することによってタンパク質を還元状態に維持します。
-20℃または-80℃での凍結は、タンパク質貯蔵の最も一般的な方法です。しかし凍結融解サイクルはタンパク質の安定性を低下させるので、一度融解したらサンプルを再凍結する必要がないように、サンプルは使い捨てのアリコートで調製する必要があります。安定性を増すためのもう一つの方法は、25-50%のグリセロールを添加して-20℃での凍結を防ぐことです。これにより、解凍することなく単一ストックからのタンパク質を繰り返し使用することができます。凍結乾燥は、分解の恐れがほとんどなく長期保存も可能になる為、組換タンパク質保存の最も一般的な方法の1つです。ただ、使用前に再構成(バッファー等への溶解)が必要であり、再構成後は液体製剤のように等分し凍結する必要があります。
タンパク質の生物学的活性は、細胞増殖アッセイまたは酵素アッセイなどのバイオアッセイを用いて日常的に測定されています。タンパク質は違う細胞種で様々な活性を発揮するため、一つのタンパク質に対して様々なアッセイが存在する可能性があります。細胞種によって目的タンパク質に対する応答が異なる為、細胞種やアッセイの種類によって決定される生物学的活性は製造者によって異なり得ます。リコンビナントタンパク質の生物学的活性は、一般的に50%有効量(ED50)を決定することにより評価されます。ED50とは、用量反応滴定において最大用量の50%を生じるのに必要なタンパク質の濃度のことです。ED50による評価は、以下の図のように、50%濃度値が容易に識別可能なシグモイド活性曲線を持つタンパク質に最も適しています。
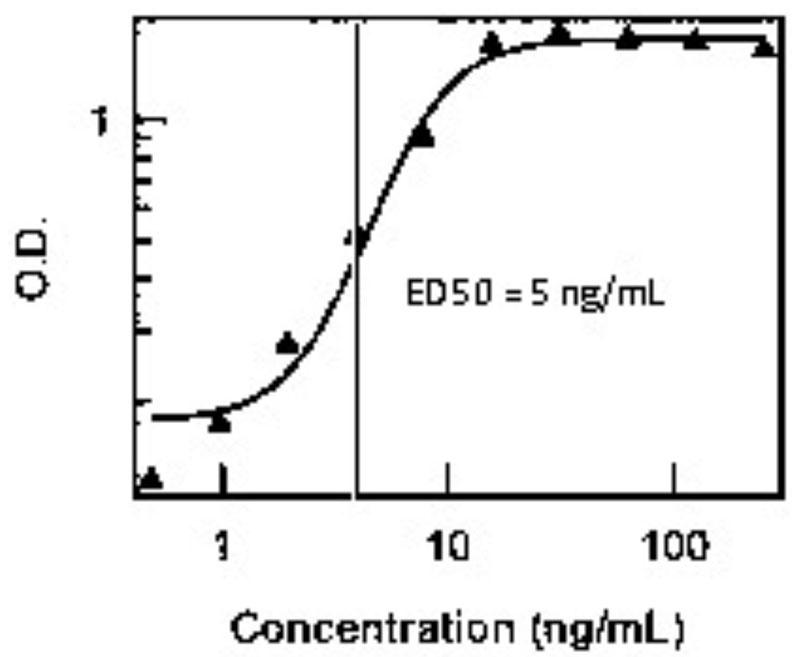
ED50は実験の出発点になりますが、ユーザーは依然として自分のアッセイに最適な濃度(さらにはED50)を見つける必要があります。また、ED50はタンパク質の2つのバッチを並べて比較するための定量的基準を確立しています。これは製造者がロット間の一貫性を保証することを可能にする他、同じアッセイを使用する異なる製造者からのタンパク質の活性を比較するためにも使用され得ます。
units/mgでの比活性は、以下の式によってng/mlのED50から決定されます:
比活性(units/mg)= 106 units/mg/ED50 (ng/ml)
酵素のようなタンパク質の場合、各ロットについて決定された比活性は通常、各製品に同梱されているロット固有のデータシートに記載されています。バイアルのロット番号はデータシートのものと同じです。
研究室で測定したユニットは、目的タンパク質を用いてアッセイを実施することから得られる実際の値です。すなわち、標的細胞で観察された活性(ED50)です。国際単位(IU)は、国際的に認められている生物学的手順に従って試験したときに特定の効果を生じるタンパク質の量です。従って、研究室で決定されたユニットが国際単位と相関するとは考えにくいです。
Cell Sciences社では、溶液中のタンパク質を検出するための様々なELISAフォーマットを提供しています。プレコートプレート付きのコンプリートキットは最も使いやすいアッセイで、プレートは既に捕捉抗体でコートされており、スタンダードや検出抗体、バッファー等、ELISAを実施するために必要な他のほとんどの試薬が含まれています。いくつかのELISAキットはプレコートなしのプレートで供給されますので、ユーザーはアッセイの第一段階としてまずプレートを捕捉抗体でコーティングします。一方、ELISAペア (例えばELI-pairs)は、捕捉抗体、検出抗体、スタンダードを含む製品で、溶液(バッファー)は含まれていません。キットの多くは、捕捉抗体と検出抗体の両方にモノクローナル抗体を使用しており、個別の製品として入手可能です(一部製品を除く)。これらの抗体のいくつかは、フローサイトメトリー用に調製したもの、FITCあるいはPEで標識したもの等がございます。
ほとんどのイムノアッセイからの滴定データはシグモイドとなり、そしてスタンダード値の線形部分は最低値、最高値を含まないかもしれません。よりよくフィットさせるために、ELISAデータを分析するための最良の方法として4パラメータカーブフィットをお勧めします。ほとんどの分光光度計には、4パラメータフィットを実行するためのソフトウェアが備え付けられており、データはSigmaPlotなどの統計ソフトウェアで分析することもできます。4パラメータ分析は、最小値および最大値の最も正確な値を出すことができ、それは最小値と最大値に近づくにつれて直線から逸脱します。 下のグラフは、ELISAで一般的に使用されているよりも広い範囲の濃度の値に対する4パラメータロジスティックカーブを示しています。
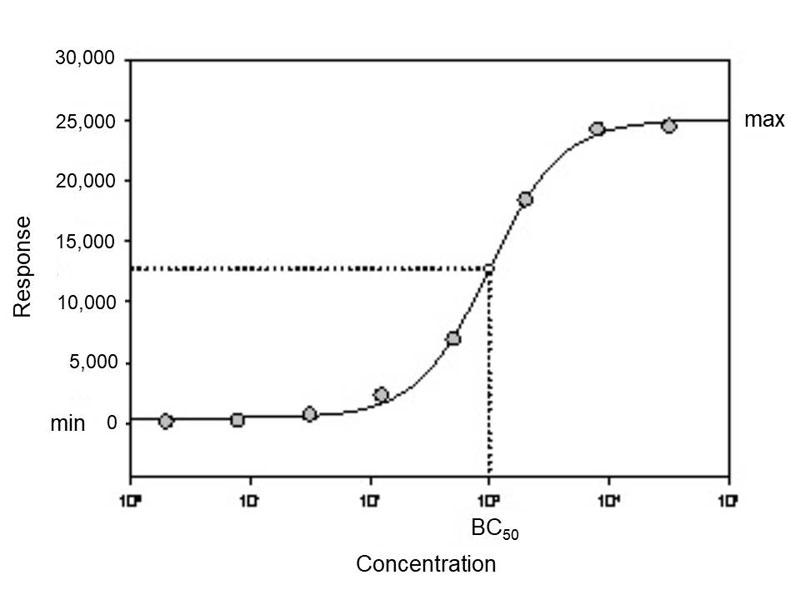
4つのパラメータは、1)最小値、2)最大値、3)50%有効量(EC50)、及び4)EC50における勾配である。EC50は、最大パラメータと最小パラメータの中間にあるポイントのX軸の値です。勾配は、曲線が急な場合は大きな値になり、曲線が浅い場合は小さな値になります。ほとんどのELISAは、増加する曲線を伴う正の勾配を持ちます。
Functional assayは、機能的に活性のある目的タンパク質のみに結合する抗体を用いて行います。活性のない目的タンパク質や複合体を形成しているものには結合しません。PAI-1、tPA、uPA ELISAキット等が挙げられます。
ウエスタンブロッティングは、サイズに基づいてタンパク質を分離する技術で、一般的にタンパク質が小さければ小さいほど、ゲルを通って速く移動します。ただし、この移動は他の要因によっても影響を受ける為、実際に観察されるバンドサイズは予測とは異なる場合があります。様々な理由が挙げられますが、最も一般的な要因の1つは、タンパク質のサイズを増加させるグリコシル化などの翻訳後修飾です。これは昆虫細胞やヒト細胞培養で作られた組換タンパク質で一般的に見られます。他にも、二量体を形成、スプライシングバリアント、電荷等様々な要因があります。






















