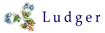バイオ医薬品のグリコシル化は、糖タンパク質医薬品の安全性および有効性プロファイルに著しい影響を及ぼす可能性があるため、糖鎖の詳細かつ正確なモニタリングは、医薬品のライフサイクルを通して不可欠な課題です。一般的に、その特定の薬物に対して指定された一連のグリコシル化の重要品質特性(GCQA)を測定するように設計された糖プロファイリングモジュールの統合されたセットの使用を含みます。これらの糖プロファイリングの多くは、蛍光タグによる糖鎖の標識を必要とします。蛍光標識は、高速液体クロマトグラフィー(HPLC)またはキャピラリー電気泳動(CE)による分離および定量を助け、質量分析による分析を改善することができます。本稿では、Quality by Design(QbD)に関する、信頼性のあるバイオ医薬品糖プロファイリングのための糖鎖蛍光標識アプローチ方法について述べています。
グリコシル化は、バイオ医薬品の安全性および有効性プロファイルにおいて重要な役割を担っています(1)。安全性の懸念として、非ヒト糖鎖によって引き起こされる可能性のある有害な事象が含まれます。例えば、IgE媒介性アナフィラキシーは、セツキシマブ(Erbitux®の名称で市販され、転移性大腸がんおよび頭頸部がんの治療に使用される抗体医薬品)で治療された特定の疾患において見出されています。この有害事象は現在、薬剤のFab領域に結合した免疫原性非ヒト型糖鎖に起因するとされています。免疫原性エピトープは、ある種のセツキシマブ糖鎖の非還元末端に見られるガラクトース-α-1,3-ガラクトースです(2)。このエピトープは、哺乳動物発現系で産生される他の生物製剤においても発見されています。
多くの生物製剤は非ヒト型シアル酸、N-グリコリルノイラミン酸(NeuGc)を含んでいます。このことが薬剤の安全性と有効性の両方に与える影響は未だ解明されていません。ヒト細胞によって天然に合成されるシアル酸は、N-アセチルノイラミン酸(NeuAc)であり、ほとんどの製薬企業が想定する、バイオ医薬品のためのシアル酸化の理想的な型であると考えています。NeuGcは非ヒト糖タンパク質中に見出され、生合成を介して、または培養液中の非ヒト血清からNeuGcをスカベンジすることにより、発現系の細胞によって生物製剤に導入され得ます。また、生体異物(xenobioticな)NeuGcエピトープが関与する生体内での有害な反応が起こる可能性、および血中の抗NeuGc抗体による中和を介した薬効の低下等のリスクが挙げられます。そのような影響が起こる可能性は、活性化ヒトT細胞がNeuGcを取り込み、ヒト血清中の抗NeuGc IgGがこれらのT細胞に結合し、補体による制御を開始したことを示すNguenらの研究(3)の他、様々な研究によって示されています。
多くのタイプの生物製剤の最適な有効性のためには特異的なグリコシル化パターンを必要とします(1)。例えばいくつかの抗体について、Fc糖鎖のコアフコシル化の割合は、抗体依存性細胞傷害(ADCC)活性レベルと逆相関します。また末端のガラクトース残基のレベルは、抗体のCDC(補体依存性細胞傷害)活性に有意に影響を与えます。エリスロポエチン(EPO)などの糖タンパク質ホルモン/サイトカインでは、糖鎖の種類(例えば、N-結合型 vs O-結合型)、それらのアンテナ構造およびシアル化度は、in vivo生物活性に大きな影響を及ぼす可能性があります。
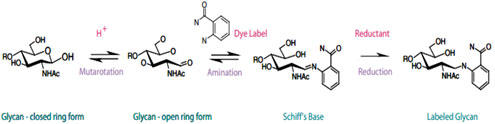
このため、糖タンパク質医薬品については、医薬品のライフサイクル全体にわたる比較可能性試験のために、グリコシル化の正確、詳細、定量的な構造的特徴付けが必要です。これは、異なるグリコシル化パラメータを測定するための多数の糖プロファイリングモジュールの使用によって達成されます。糖鎖の蛍光標識は、このような糖プロファイリングの重要な要素です(4)。現在、多くの糖鎖標識方法があり、特定の生物製剤に使用するものの選択は慎重に行う必要があります。適切な標識方法および分析プラットフォームの使用は、複雑な糖鎖混合物中の個々の種類の良好な分離およびそれらの種の信頼できる定量を可能にします。特定の用途に対する標識の選択が不十分であると、重要な糖鎖種の定量が不正確になり、良好なグリコシル化を有する薬物バッチが不合格となるリスクが高くなります。より深刻なケースでは、規格外のグリコシル化パターンを有するバッチが通過してしまうこともあります。
本稿の後半では、「哺乳動物発現系で産生されるバイオ医薬品のグリコシル化の効果的なモニタリングのための蛍光標識の使用」に焦点を当てます。糖プロファイリングモジュールは、糖鎖、シアル酸、中性単糖の分析に用います。製品管理のためのQbDにおけるそれらのサービスについても説明します。