ホルムアルデヒド、パラホルムアルデヒド、ホルマリンという用語は、良く混同して使用されます。ホルムアルデヒドはもっとも簡単なアルデヒドで、分子式は CH2O です。パラホルムアルデヒドは、重合したホルムアルデヒドで、粉末をドラフト内で加熱溶解して使用します。細胞への浸透力が弱く、通常は、抗体が細胞内に十分に浸透できるだけの透過性が得られません。多くの場合、二回目の透過処理ステップが必要となります(下記参照)。
ホルマリンは 37% ホルムアルデヒドを含有する液体で、通常はホルムアルデヒドの重合を防ぐために 10-15% メタノールが添加されています。上述の理由(有機溶媒に関する項を参照)から、ホルマリンにメタノールが含まれていることに注意してください。10% ホルマリンは、ほぼ 4% ホルムアルデヒドに相当し、細胞を部分的に透過処理するのに十分な量のメタノールが含まれていますが、固定を長期間行わない限り、完全には透過されません。
固定により、抗原部位が破壊されたり、覆い隠されたりする可能性があり、その結果、染色強度が低下します。場合によっては、固定の前、あるいは固定せずに抗体を添加することで、優れた結果が得られることがあります。この手法は特に、細胞表面に露出したタンパク質に適していることから(図1参照)、まず最初に、抗体を培地に加え、ターゲットが細胞表面に存在するかどうかを確認します。 細胞表面分子の多くは、常に、または、架橋により細胞内に移行する(抗体は二価であることから、架橋を促進します!)ため、慎重に進めてください。また、細胞間接着に関与する抗原は、抗体が結合することで機能的に影響を受ける可能性があります。
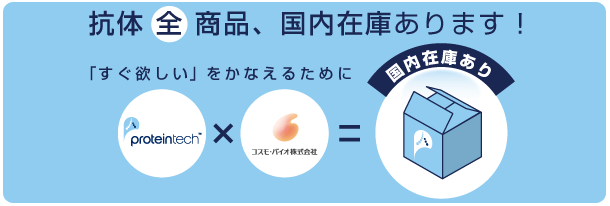
図1 固定後(左)および固定前(右)に抗体を添加した例
細胞を同じ抗カドヘリン抗体で染色した(緑色で示す)。左図: パラホルムアルデヒドで固定し、メタノールで透過処理した細胞を抗体で染色。右図: 生細胞の増殖培地に抗体を添加。この例では、左図は損傷していないタンパク質の「実際の」局在を示しますが、右図はこの抗体のターゲットが、細胞接着において機能的に重要であることをはっきりと示しており、細胞接着の研究に有用な情報となります。
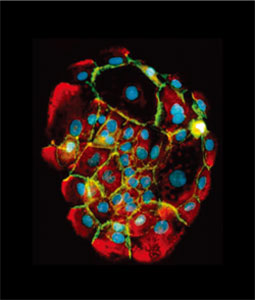
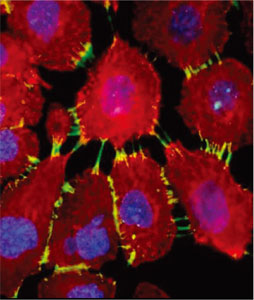
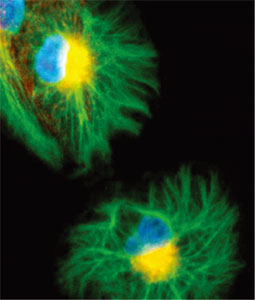
ホルマリン/ホルムアルデヒド固定を行うプロトコールの大半で、界面活性剤(穏やか〜中等度の順で、サポニン/ジギトニン、0.1 - 0.5% Triton-X100、NP40)や、メタノール/アセトンなどの有機溶媒を用いた、二回目の透過処理を行います。(有機溶媒で固定した場合は、もちろん2回目の透過処理は必要ありません!)図2は、透過処理の効果を示す例です。
図2 細胞を、パラホルムアルデヒド(PFA)のみ(左)、または、パラホルムアルデヒドの後にメタノール(右)で固定し、糖鎖抗原(赤)および細胞骨格タンパク質(ミオシン、緑)に対して染色を行いました。右図は、より「正確」にミオシンが染色されていますが、メタノールによる透過処理により、左図に示された細胞表面の糖鎖の染色が観察されません(右)。細胞内の緑色の染色(左)は、PFA固定により形成された多くの小孔を通して、抗体が細胞内部に部分的に浸透した(明るい点)ことを示します。非透過性細胞(左)ではほとんど抗体が浸透できませんが、同じ種類の細胞で2回目の透過処理を行うと(右)、抗体が細胞内に浸透して細胞骨格全体を検出することができます。細胞の漏出が、ホルムアルデヒド処理の前から起こっていたのか、固定による影響なのかは不明です。しかし、右の画像がなければ、抗原がわずか数個の細胞にのみ含まれており、点状に染色されるという、誤った結論に導かれてしまいます。
抗体の中には、標的分子の小さな領域のみを認識するものがあります。これは、大きいタンパク質の小さな領域に対して作製された、モノクローナル抗体やペプチド特異的抗体の特徴です。市販の抗体は、多くがこの種類ですが、全タンパク質抗原に由来する抗体を使用することもできます。このような多価抗体には、大きなタンパク質全体の小さな部分をそれぞれ認識するクローナル抗体が混合されています(図3参照)。
一般的に、抗体が複数の抗原結合部位を持つ(多価)ほど親和性が高く、特に局在化、免疫沈降、イムノブロットなどの実験に有用です。しかし、モノクローナル抗体やペプチド特異的抗体も、全く使用できないわけではありません。これまでの経験上、全タンパク質に対して作製された抗体は、分子全体の集合に対して選択性を示す可能性があります。例えば、ヘテロ二量体からなる四量体の各サブユニットが、認識されない場合もあります。また、親和性が高く、1種類のエピトープを認識する抗体は、リン酸化部位、O-GlcNAc 修飾、特異的な立体構造エピトープなどの検出に非常に有用です。
多価抗体と、一種類のエピトープを認識する抗体を、両方組み合わせて使用することで、タンパク質の同定だけではなく、機能の評価も可能になります。
図3 全体像を見ていない一人や二人の意見を参考にするよりも、全員の意見から「これは間違いなく象です」と結論を出す方が確実です。
多くの場合、免疫染色において問題となるのは、抗体や細胞ではなく染色方法です。厳密なプロトコールに忠実に行うことで、一般的に細胞表面の染色はうまくいきますが、細胞内染色はまた別問題です。免疫染色では、はるかに大きい抗体を用いて、内部細胞構造の低分子を検出するからです(ネイティブ抗体は非常に大きいです!)。細胞膜に穴が開いていて、抗体が細胞内部に十分に浸透できる大きさでなければなりませんが、穴によって起こる問題はできるだけ低減する必要があります。
Nancy が本稿で述べているように、(特に初めて)細胞内ターゲットの免疫染色を行う場合に、万能な方法はありません。どの方法にも欠点があります。この免疫染色方法は、何が分かって、何が観察できないのか?新しい抗体と抗原を別々に組み合わせて、それぞれに対して、様々な免疫染色法を一通り試してみてください。Nancy のアドバイスを参考にして、免疫染色を始めてみてください。