1. はじめに
免疫染色は、抗体を利用して生細胞および固定細胞および組織内の生物学的標的を標識する長年使用されている方法です。免疫染色での一般的なターゲットはタンパク質ですが、実は脂質も免疫染色が可能です。
- ガラスのカバースリップまたはスライドにマウントする
- メタノールやホルムアルデヒドなどの試薬が化学固定する
- 界面活性剤溶液を使用して細胞を透過処理する
抗脂質抗体を用いて免疫染色する場合、これらのステップにおいて、抗脂質抗体特有の条件検討が必要となる可能性があります。この記事では、脂質の検出と定量を成功させるために考慮すべき脂質免疫染色の特定の側面を詳しく掘り下げます。
2. 固定
免疫染色では化学的固定が必要ですが、脂質抗体の場合、固定によりエピトープが隠されたり壊されたりする可能性があり、条件の検討が必要です。
細胞の固定に使用される最も一般的な試薬はホルムアルデヒドとメタノールです。ただし、これらの方法は全く異なる方法で固定がなされます。ホルムアルデヒドは遊離アミンと容易に反応する架橋試薬です。したがって、アミン基を持つタンパク質やアミノ酸の N 末端と容易に反応します。
一方メタノールはタンパク質の架橋ではなく脱水による沈殿を起こす有機溶媒です。メタノール、およびアセトンなどの溶媒は、バックグラウンドシグナルが減少するため、タンパク質染色には好ましい場合がありますが、これらは細胞から脂質を可溶化して除去する可能性があります。
このため、脂質の免疫染色では、通常固定にメタノールまたは類似の溶媒を使用することはお勧めしません。タンパク質を同時染色する必要があり、どうしてもメタノール固定が避けられない場合は、脂質の架橋剤を用いたものとメタノールを用いたもので染色結果を比較し条件決定することをお勧めします。
もう一点考慮すべき固定のパラメータは、架橋反応のストリンジェンシーです。ストリンジェンシーを変える手段として、ホルムアルデヒドの濃度を変える、グルタルアルデヒドなど他の試薬を追加するという方法があります。
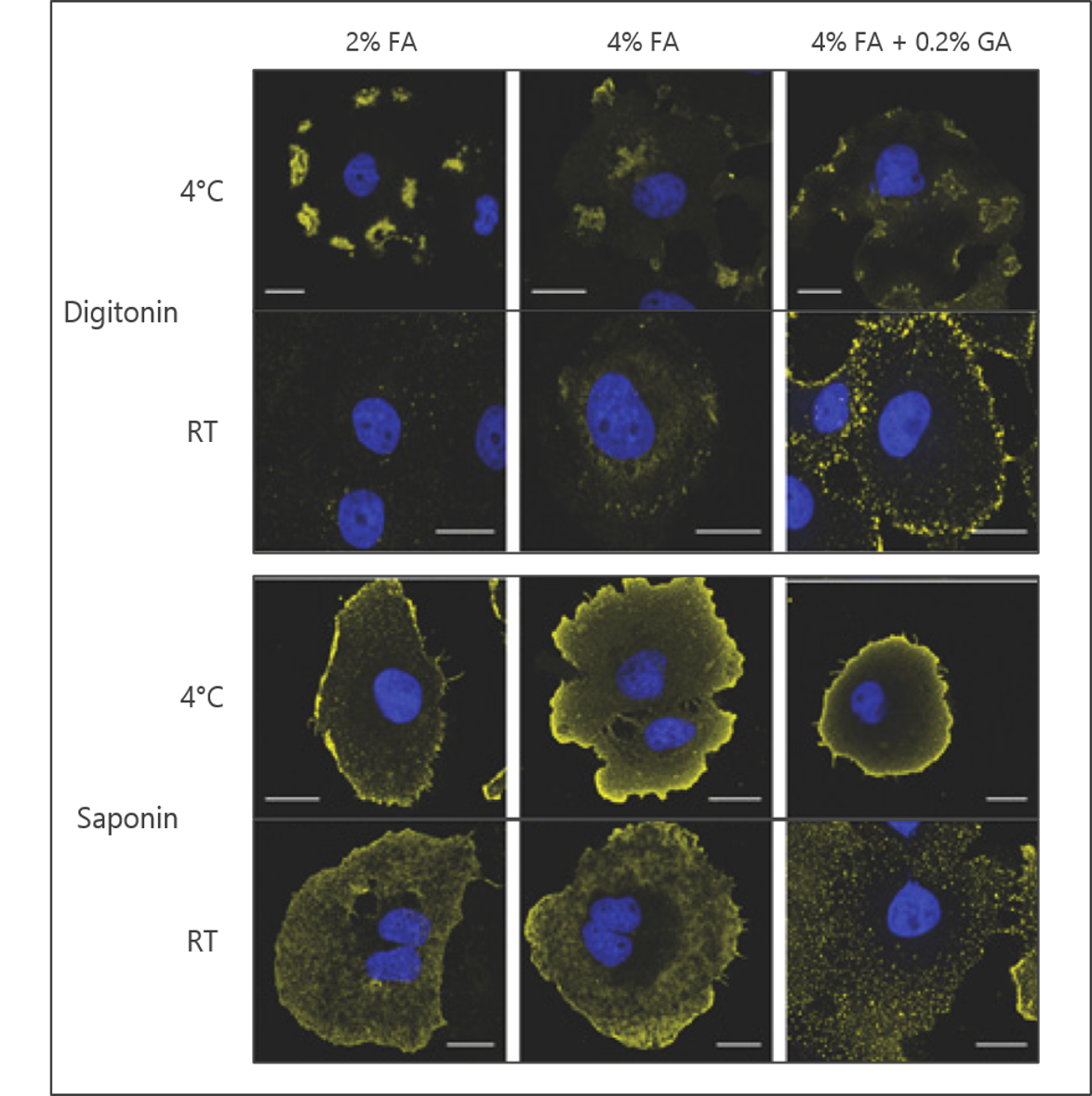
グルタルアルデヒドはホルムアルデヒドと同様の化学反応をしますが、炭素鎖が長いため、生成する架橋はホルムアルデヒドのものほど近接させるものではありません。ストリンジェンシーの効果は、ホスファチジルイノシトール 4,5-二リン酸 (PI(4,5)P2) 抗体が使用されている図 1に示されております。
図 1:脂質抗体を固定ストリンジェンシー、透過処理試薬、染色温度を変更した際のシグナルへの影響
抗 PI(4,5)P2 抗体からの代表的なシグナルを黄色で示されている。 DAPI による核 DNA 染色は青色で示されている。画像引用:Hammond et al. Biochem J 15 August 2009; 422 (1): 23-35.
3. 透過処理
透過処理とは、界面活性剤を用いて細胞膜に穴または細孔を作り、染色抗体がアクセスできるようにすることを指します。ここで使用される界面活性剤は、細胞小器官にアクセスするという目的を考慮すると、タンパク質に対して非常に便利なものとなります。ただし、抗体のターゲットが脂質の場合、特定の細胞小器官に対して異なる可溶化効果があるため、透過化試薬の選択には細心の注意が必要です。
透過処理に最もよく使用される試薬は非イオン性界面活性剤の Triton X-100 です。この界面活性剤は非特異的にすべての細胞膜を透過化するため、核膜を効果的に透過できる唯一の透過化試薬です。一方で、ゴルジ体や小胞体のような一部の構造を完全に可溶化してしまう場合があり、また高濃度だと、タンパク質を抽出したり、細胞を溶解したりすることもあり、シグナルの局在や全体的な強度に影響を与えることがある、非常に強い試薬です。
サポニンとジギトニンも透過処理によく使用される透過化試薬です (図 1)。サポニンは両親媒性、ジギトニンは非イオン性ですが、どちらもコレステロールに対して選択的です。この選択性のため、細胞膜の透過化が可能になりますが、一方で核やミトコンドリアなどの他の一部の細胞小器官は透過処理ができません。またこれらの界面活性剤は染色中に維持できないと洗い流されてしまうため、可逆的な試薬です。
4. 温度
多くの抗体ベースの検出法では、インキュベーション温度が室温(RT)でも4℃でも、結果に優位な変化を与えることは少ないですが、脂質を用いたICCでは、温度を注意深く考慮する必要がございます。
上述したように、ホルムアルデヒドとグルタルアルデヒドは細胞の固定に用いられる最も一般的な試薬であり、ほとんどが一級アミン基と反応しタンパク質を架橋します(図2)。これらの試薬が不飽和アシル鎖やアミン頭部基を含む脂質と反応する可能性はあるが、一般にホルムアルデヒドやグルタルアルデヒドの架橋が脂質と直接起こる可能性は低いです。つまり、固定後も細胞膜内での脂質はある程度固定されず動いている可能性があります。
固定後の脂質の移動は、主に、特定の細胞膜の流動性と染色を行う温度という2つの事柄に影響される(図1)。これらの理由から、対象となる細胞膜が高流動性であることがわかっている場合は、染色手順を4℃で行うことが望ましいです。また、二次抗体使用後に細胞を後固定することで、付着した抗体が近隣のタンパク質に架橋されるため、脂質の移動を抑えることができます。
図2. 細胞固定剤 ホルムアルデヒドとグルタルアルデヒドの分子構造
5. コントロール
抗体の特異性確認のための方法としてには、ノックアウト動物/細胞株の使用、およびブロッキングペプチドとのプレインキュベーションが一般的に用いられます。
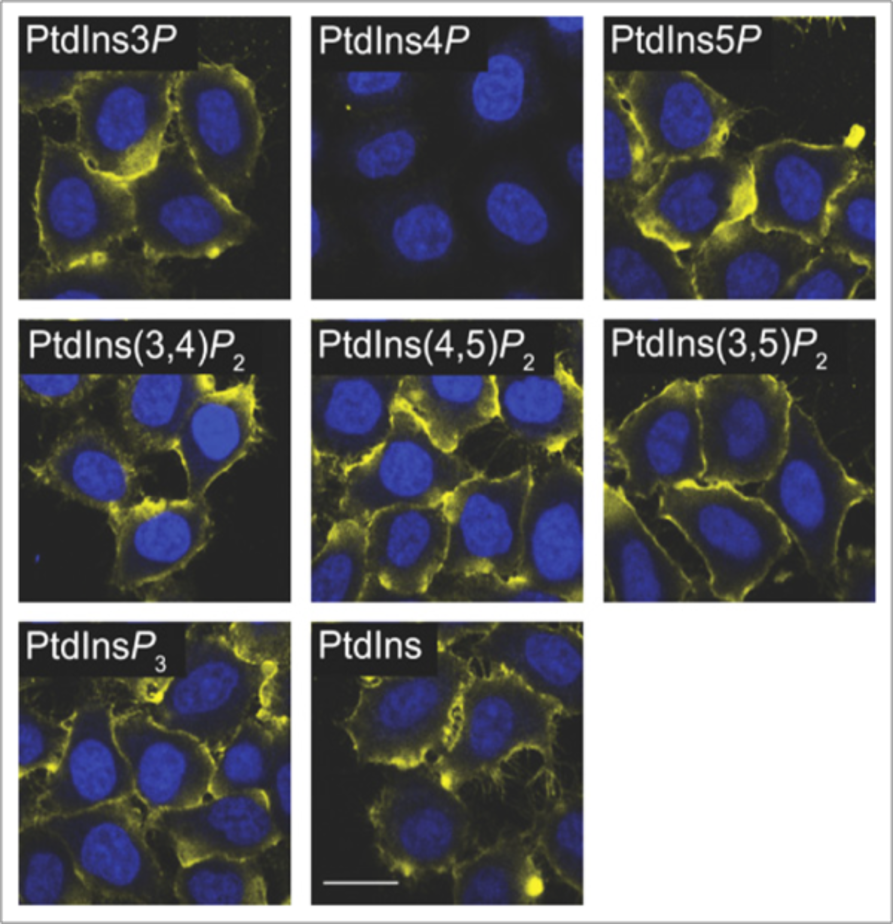
上記で挙げたプレインキュベーション等の抗原による競合的手法は、脂質抗体でも同様に適応できます。ECL社で推奨する簡単なプレインキュベーションの方法の 1 つは、さまざまな脂質を構造に持つリポソームと脂質抗体をプレインキュベートすることです。この例を図 3に示します。ここでは、抗PI4P抗体を、さまざまなホスホイノシチドをロードしたリポソームとプレインキュベートした実験です。図に見られるように、抗体をPI4P リポソームとプレインキュベーションした場合にのみシグナルの消失が観察されており、これはシグナルが実際に特異的であることを示しています。遊離の水溶性 diC8 脂質を使用しても同様の結果が得られる可能性はありますが、これは抗体によって異なるため、ご自身でご確認いただき、その結果をご判断いただく必要がございます。
図3. 抗 PI4P 抗体を、抗体染色のコントロールとしてさまざまな PIPn リポソームとプレインキュベートした。シグナルの損失は、PI4P リポソームでのみ観察された。
画像引用:Hammond et al. Biochem J 15 August 2009; 422 (1): 23-35.
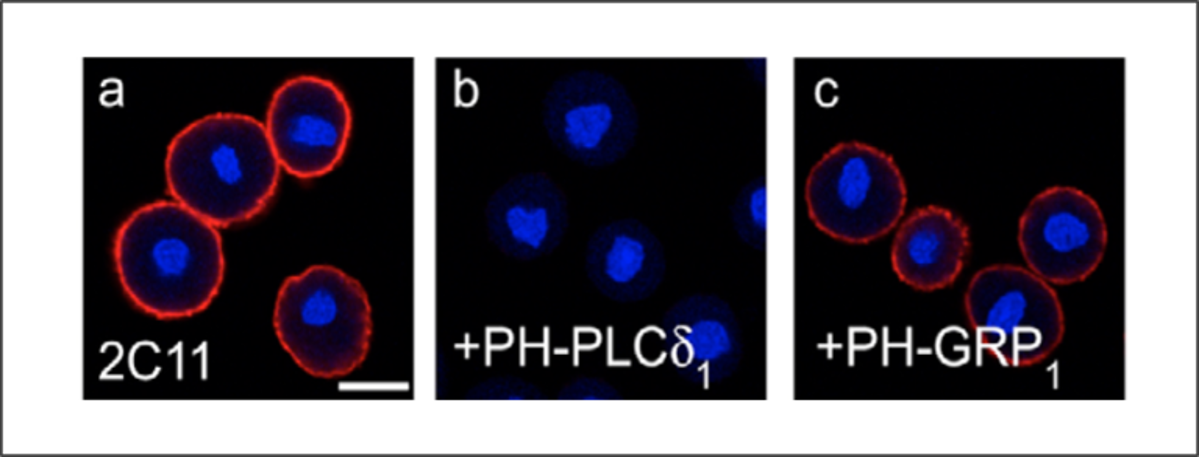
リポソームプレインキュベーション以外の方法としては、ターゲット脂質に特異的な脂質結合ドメインを系に導入するという方法もあります。図4は、PI(4,5)P2抗体による細胞膜染色を示します(図4)。パネルb, cでは、細胞を PI(4,5)P2 (PH-PLCδ) または PI(3,4,5)P3 (PH-GRP) に特異的な脂質結合ドメインとともにプレインキュベートします。 PI(4,5)P2 結合ドメインが適用された場合にのみ抗体染色が失われ、これもシグナル特異性を示しています。
図 4: PI(4,5)P2 結合ドメイン (b) または PI(3,4,5)P3 結合ドメイン (c) のいずれかで前処理した細胞を、抗 PI(4,5)P2 処理単独と比較した。(a) シグナルの損失は、PI(4,5)P2 結合ドメインを適用した場合にのみ観察されます。
画像引用: Hammond et al. J Cell Sci 15 May 2006; 119 (10): 2084-2094.
6. その他の考慮事項
抗体染色に基づく脂質レベルの定量に関する質問もよく受けます。さまざまな固定および透過化技術によって染色パターンに違いが生じる可能性があることを考慮すると、単一の染色法で特定の脂質の細胞レベル全体を明らかにできる可能性は低いです。さらに、内在の脂質結合タンパク質は固定後も標的脂質に結合したままである可能性が高く、認識可能な脂質プールの一部をマスクしている可能性があります。
そのため、異なる処理条件間でのシグナル強度の比較は禁止、とまでは行きませんが、得られるデータは正確ではあるが相対的な定量と考えるのが賢明かと思われます。
上記のコントロールの代替として、特定の脂質の増加または減少をもたらすことが知られているアゴニスト、阻害剤、または遺伝子操作の使用することも可能ですが、その際には細心の注意が必要です。これらの試薬の使用タイミング、インキュベート時間、濃度は、付随するシグナル伝達経路の応答に大きな影響を与える可能性があります。この処理で得られた結果が想定から逸脱した場合、抗体の非特異性によるもの以外の結果を見ている可能性がございます。染色後に特定の刺激による予期せぬ結果が観察された場合は、上記の競合プレインキュベーションコントロールを使用して実験を再検討することをお勧めします。
7. まとめ
脂質免疫染色中に発生する可能性のある無数の問題は複雑に思えるかもしれませんが、多くの脂質抗体はすでに十分に特徴付けられており、信頼できる代表的な結果が科学文献で使用されています。この記事で取り上げたポイントはガイドとして提供されており、製品付属の実験プロトコルが利用できない場合や、新しい実験系を立ち上げる際に考慮事項として役立ていただければと思います。
8. 参考文献
- Guo Z., Chunfang T., Yanrui Y., Liu K. Immunofluorescence staining of phosphoinositides in primary mouse hippocampal neurons in dissociated culture. STAR Protocols 2022 (3)
- Elizabeth A. Hoffman, Brian L. Frey, Lloyd M. Smith, and David T. Auble Formaldehyde Crosslinking: A Tool for the Study of Chromatin Complexes (2015) JBC 290, NO. 44, pp. 26404 -26411
- Hammond GR, Dove SK, Nicol A, Pinxteren JA, Zicha D, Schiavo G. Elimination of plasma membrane phosphatidylinositol (4,5)-bisphosphate is required for exocytosis from mast cells. J Cell Sci. 2006;119(Pt 10):2084-94.
- Hammond GR, Schiavo G, Irvine RF. Immunocytochemical techniques reveal multiple, distinct cellular pools of PtdIns4P and PtdIns(4,5)P(2). Biochem J. 2009;422(1):23-35.