技術情報
- チャンバースライドに細胞を播種し、適切な培地で1〜2日間培養を行う (細胞はプレートに強く接着する必要があります)。
注意:一部の細胞株では、細胞の付着を助けるために、チャンバースライドにポリリジンなどの特別なコーティングが必要となります。コーティングの具体的な種類は、チャンバーの種類や細胞株によって異なるため、経験的に決定する必要があります。 - 氷冷したアッセイバッファーで細胞を3回洗浄する。
| 濃度 | |
|---|---|
| Na2HPO4 | 0.016 M |
| KH2PO4 | 0.003 M |
| NaCl | 0.14 M |
| (%) | |
|---|---|
| ICC-PBS | 97.95 |
| Bovine serum albumin | 2 |
| NaN3 | 0.05 |
- 氷冷したアッセイバッファーに、適切な希釈率の一次抗体を加える。
- 4℃で1〜2時間インキュベートする。
- 氷冷したアッセイバッファーで細胞を3回洗浄する。
- 氷冷したアッセイバッファーに適切な希釈率の蛍光標識二次抗体を加え、遮光して4℃で1時間インキュベートする。
- DAPI(脱イオン水またはジメチルホルムアミド(DMF)に溶解した5mg/mlストック溶液を作製し、最終的にはICC-PBSで500nMに希釈)を加え、室温で5分間インキュベートします。
- 氷冷したアッセイバッファーで3回洗浄し、よく水を切ります。
- ICC-PBSを加えて細胞を覆い、顕微鏡観察を行う。
- 氷冷したアッセイバッファーに、ATTO標識一次抗体を適切な希釈率で加える。
- 4℃で1時間インキュベートする。
- DAPI(脱イオン水またはジメチルホルムアミド(DMF)に溶解した5mg/mlストック溶液を作製し、最終的にはICC-PBSで500nMに希釈)を加え、室温で5分間インキュベートします。
- 氷冷したアッセイバッファーで3回洗浄し、よく水を切ります。
- ICC-PBSを加えて細胞を覆い、顕微鏡観察を行う。
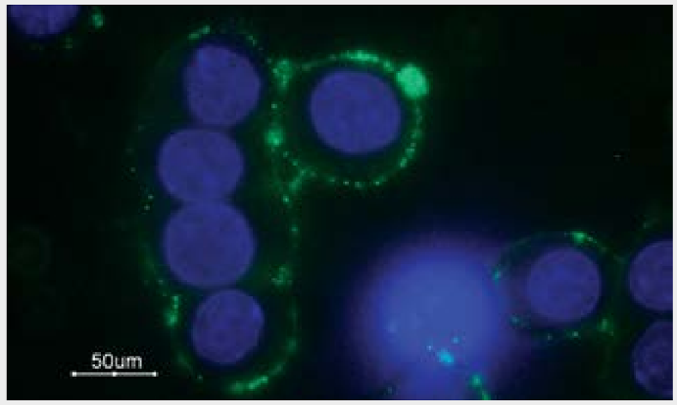
図1.GH3細胞におけるα1B-アドレノセプターの発現
生きたGH3細胞におけるα1B-adrenoceptor細胞表面領域の検出。
細胞を Anti-α1B-Adrenergic Receptor (extracellular) Antibody (AAR-018) (1:100)で染色した後、ヤギ抗ウサギAlexa Fluor 488二次抗体(緑)で染色した。細胞核は、DNA色素Hoechst 33342(青)で染色した。
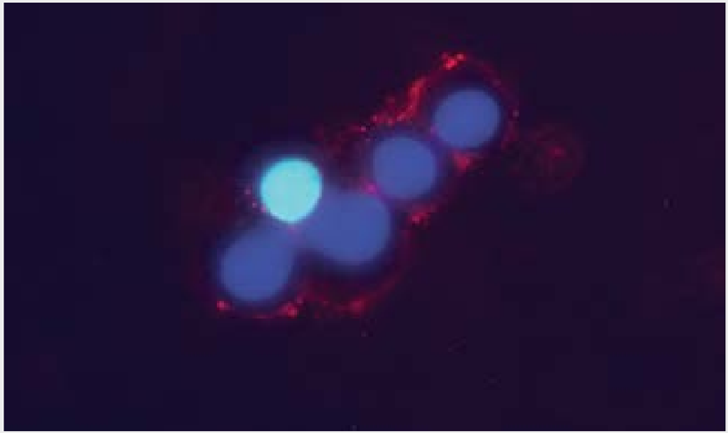
図2.PC12細胞におけるノルアドレナリントランスポーター(NET)の発現
生きたPC12細胞におけるNET細胞表面領域の検出。
細胞を Anti-Noradrenaline Transporter (extracellular) Antibody (AMT-002) (1:100)で染色した後、ヤギ抗ウサギAlexa Fluor 594二次抗体(赤)で染色した。細胞核は、DNA色素Hoechst 33342(青)で染色した。
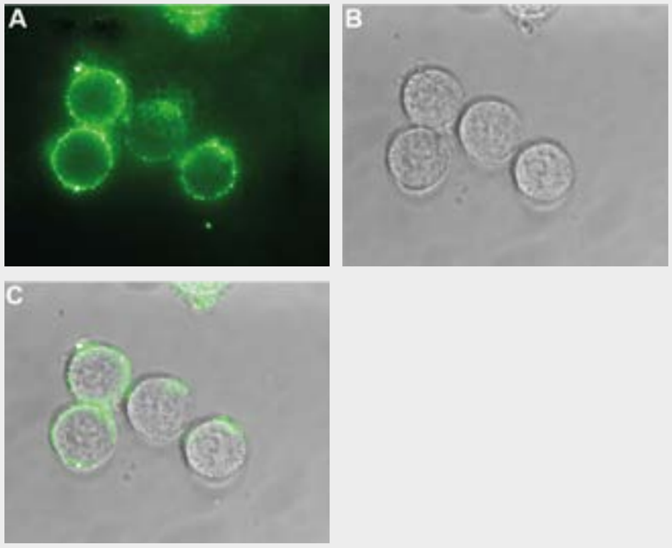
図3.ヒトCOLO-205細胞におけるKCNQ1の発現
生きたCOLO-205細胞におけるKCNQ1細胞表面領域の検出。
(A) Anti-KCNQ1 (extracellular) Antibody (APC-168) (1:50)、続いてヤギ抗ラビットAlexaFluor-488二次抗体(緑)を用いた細胞外染色像。(B)細胞のライブビュー。(C) AとBのマージ像。
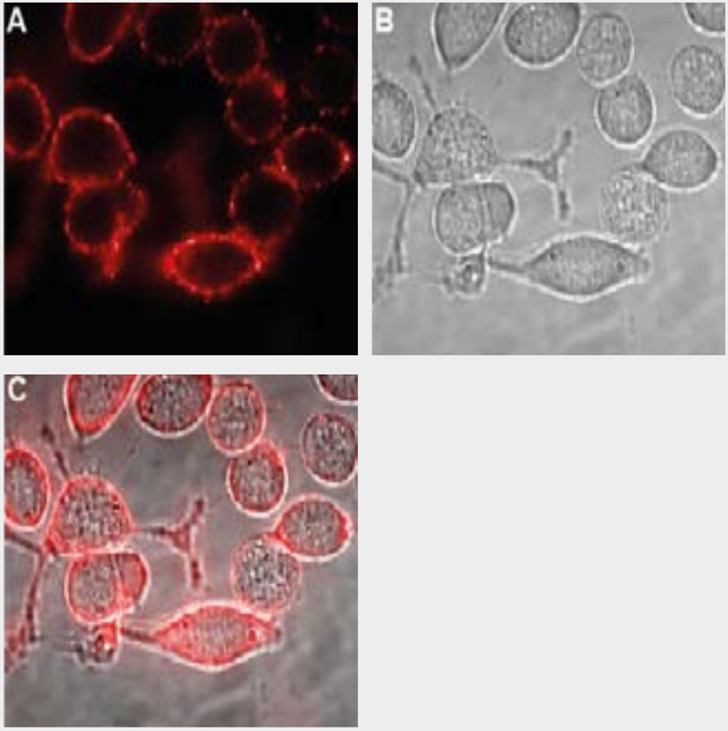
図4.ヒトU-87細胞におけるKir4.1の発現
生きたU-87細胞におけるKir4.1細胞表面領域の検出。
(A) Anti-Kir4.1 (KCNJ10) (extracellular) Antibody (APC-165) (1:100)、続いてヤギ抗ラビットAlexaFluor-594二次抗体(赤)を用いた細胞外染色像。(B)細胞のライブビュー。(C) AとBのマージ像。
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては
使用しないように、十分ご注意ください。


























