技術情報
背景
vNARとは?
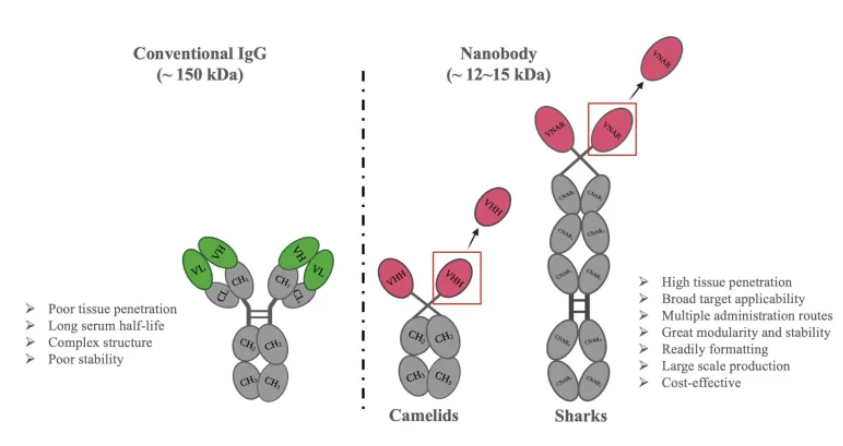
軟骨魚類(例:サメ)がもつ免疫グロブリン「IgNAR(new antigen receptor)」に由来する抗原結合部位(可変領域)です。これは、ラクダ科動物に見られる重鎖抗体由来の可変領域「VHH(Variable domain of Heavy-chain antibody)」と並んで、ナノボディを構成する主要なドメインの一つとされています。vNARはその構造上、わずか12~15 kDa(2~4 nm)という極めて小さいサイズでありながら、従来型モノクローナル抗体と比べて多くの利点を有しています。
VHH と vNAR の違い
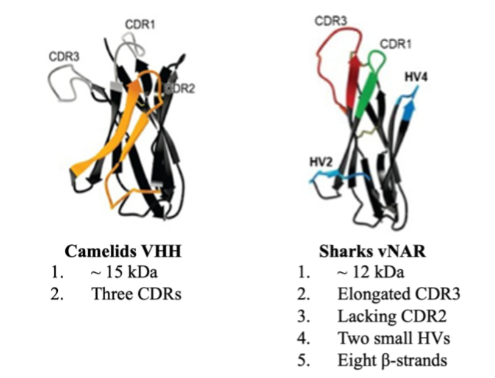
ラクダ科動物に見られる重鎖のみからなる抗体は、2本の同一の重鎖で構成されています。さらに各重鎖は、2つの定常ドメイン(CH2とCH3)、ヒンジ領域、そして抗原認識を担う可変VHHドメインで構成されています。VHHドメインによる抗原の結合は、CDR1、CDR2、CDR3という3つの相補性決定領域(CDR)によって媒介されます。
対照的に、IgNARは2つの同一の重鎖から構成され、それぞれが5つの定常ドメイン(CNAR1~5)と、抗原認識を担う可変vNARドメインから構成されています。また、vNARドメインは、CDR1、CDR3、そして2つの小さなHVループ(HV2とHV4)を介して抗原に結合します。vNARはIgスーパーファミリーに属しており、8本のβストランドからなるβサンドイッチ構造を持っているという特徴があります。
vNARのメリット
独自の構造設計
vNARは、哺乳類抗体とは異なる進化経路をたどっており、8本のβストランドから成るコンパクトな骨格と伸長したCDR3ループを特徴としています。抗原結合部位(パラトープ)は、CDR1、CDR3、そして2つの追加ループ(HV2およびHV4)によって構成されており、従来型抗体では認識が難しい非典型的なエピトープを識別することが可能です。例えば、ある種のvNARは、GFP(緑色蛍光タンパク質)のような抗原の隠れた領域に結合でき、通常の抗体ではアクセスできない部位を標的にすることができます。このような構造上の独自性は、認識可能なエピトープの幅を広げ、複雑な生体内相互作用の研究に新たな可能性を提供します。
また、哺乳類のVHドメインとは進化的に離れているため、ヒト抗原の検出に優れています。さらに、哺乳類バイオマーカーに対する交差反応性が低減され、より高い特異性が確保されます。
過酷な環境下での卓越した安定性
高濃度の尿素(約350 mM)や塩分を含むサメの血液という過酷な環境で進化してきたvNARは、非常に高い耐性を示します。複数の非定型システイン残基がジスルフィド結合を形成し、その構造を強固に安定化させています。これにより、80°Cを超える高温環境に1時間さらされても構造を保ち、生理的条件に戻すことで再び機能を回復することができます。このような高い耐久性により、vNARは長期保存や厳しい環境下でのアプリケーションに最適となっています。
多様性の高い抗体ライブラリー
whitespotted bamboo sharkは、IgNARクラスターが完全にマッピングされたゲノムを持つモデル種として、多様なvNARライブラリーの構築における基盤となっています。このような染色体レベルでの完全性により、膨大な種類のナノボディへのアクセスが可能となり、ニッチな抗原に対する高親和性の結合分子を発見する可能性が高まります。これは、オーダーメイドの研究ニーズにとって重要な資産です。
自然成熟による優れた親和性
免疫されたサメは、体内で繰り返されるアフィニティ・マチュレーション(affinity maturation)のプロセスを通じて、vNARを産生します。このプロセスにより得られるナノボディは、合成ライブラリーやナイーブライブラリー由来のものと比べて、100〜1000倍も高い結合親和性を示します。このような高精度な結合能は、オフターゲット効果(標的外作用)を最小限に抑えることが極めて重要ながん研究などでの治療標的への応用において非常に有用です。
高いコスト効率
小型で飼育しやすいbamboo shark を用いることで生産が効率化され、ラクダ科動物を用いたシステムと比較してコストを30%削減することが可能です。
多分野での応用例
タンパク質間相互作用の解析から細胞治療研究に至るまで、精密な生物学的探究のためのツールとして活用されています。
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては
使用しないように、十分ご注意ください。