
茶本 健司 先生

免疫が異常増殖細胞を攻撃し、がんの発症を抑えているという免疫監視機構の考え方は、1900年初頭 P.Ehrlichらにより提唱され、中頃に M.Burnetらによって展開されてきた。1990年代には共通がん抗原の遺伝子が同定され、免疫ががんを非自己として認識することが科学的に証明された。しかし実際は治療効果を発揮する方法を見つけ出すまでに時間がかかり、長い間がん免疫治療は日の目を浴びることはなかった。現在のように免疫治療が第4のがん治療法として多くの患者に適応されていることは、長いがん免疫治療の歴史からすれば、これはごく最近のことである。現在、承認されているがん免疫治療法には PD-1阻害抗体、CTLA-4阻害抗体、Chimeric antigen receptor (CAR)-T細胞治療があるが、ほとんどのがん免疫治療は PD-1阻害抗体をベースとした(併用)治療法になっているのが現状である。ここではがん免疫治療の現状と今後の展望を概説する。
生体には、本来がん細胞を除去するための免疫監視機構が備わっており、がんの発症が抑制されている。2002年に Dunn, Schreiberらによって「がん免疫編集機能」が提唱された(1)。がん免疫編集機能は「排除相」「平衡相」「逃避相」の3つの段階からなる。排除相ではがん免疫監視機構により、日々出現する多くの異常増殖細胞を排除する。しかし、変異の蓄積によりがん免疫監視機構に排除されなかった異常増殖細胞が存在すると、それらの細胞は平衡相に入る。平衡相では免疫細胞による排除スピードと異常細胞の増殖が見かけ上同じになり、大きさが変化しない前がん状態になる。しかし、逃避相では免疫監視から逃れた異常細胞が徐々に増殖し、その結果、「がん」として顕在化する。がん細胞に対する免疫監視機構は様々な免疫細胞により構成されているが、主に細胞傷害性キラーTリンパ球が、がん細胞に特異的に発現する多様な抗原を認識し、直接的にがん細胞を殺傷する。がん免疫逃避機構としては腫瘍抗原・HLA発現の消失や免疫抑制物質の発現、免疫抑制性細胞の誘導等が考えられている。1992年、京都大学の石田、本庶らにより発見されたPD-1は、PD-1欠損マウスが自己免疫疾患を発症する事により免疫応答の制御因子である事がわかった(2,3)。その後、PD-1シグナルを阻害する PD-1阻害抗体を用いてマウスモデルでがん縮小効果が確認され、PD-1とそのリガンドである PD-L1 (PD-1 Ligand1) との相互作用ががんの免疫逃避機構に重要な役割を果たしていることが世界で初めて証明された(4)。PD-1 は活性化したT細胞やB細胞、骨髄系細胞の一部に発現し、PD-L1 や PD-L2 との結合によって抗原受容体刺激を抑制し、免疫応答を制御する免疫のブレーキの働きをする因子(免疫チェックポイント)の1つと考えられている。
2010年に PD-1抗体であるニボルマブの臨床効果が発表され、2014年世界に先駆け本邦において悪性黒色腫に対してニボルマブが認可された。以降、PD-1抗体治療をはじめとするがん免疫療法はがん治療に革命を起こした。様々な臨床試験で良好な結果が報告され、現在本邦では悪性黒色腫や非小細胞肺癌 (NSCLC)、腎細胞癌、ホジキンリンパ腫、頭頸部癌、胃癌、尿路上皮癌に対して PD-1抗体治療は保険適用となっている。しかし、様々ながんで効果が証明されている一方で、PD-1抗体単剤での奏効率は最も効果がある悪性黒色腫でも 40%にとどまり、全く無効である症例も存在する。近年、tumor mutation burden の多さや、ミスマッチ修復遺伝子の欠損、micro satellite instability の有無が PD-1抗体の治療効果と大きく関係している事が報告され、2017年5月、成人および小児における切除不能/転移性の高度マイクロサテライト不安定性 (MSI-H) または dMMR を示す固形がんに対して FDA が PD-1抗体ペムブロリズマブの適用を追加した。これは、多くの体細胞変異を持つ腫瘍細胞が変異由来の抗原(ネオ抗原)を発現し、非自己として認識されるためキラーT細胞の免疫応答も強いからではないかと考えられている。しかし、cold tumor と言われる変異が少ない症例でもある一定の割合で PD-1抗体の治療効果が認められることも事実である。現在、多くの大学機関、企業が他の免疫チェックポイントに対する抗体を開発し、多くの臨床治験が進められている。
T細胞養子免疫治療の歴史も比較的長い。1990年以前から非特異的T細胞やNK細胞を高濃度 IL-2 で培養し、がん患者に戻す非特異的養子免疫療法があった。1986年に Rosenbergらは腫瘍組織からがん反応性T細胞を培養し、がん特異的T細胞養子免疫治療の可能性を示した(5)。さらにがん抗原特異的T cell receptor (TCR) の遺伝子を非特異的T細胞に導入し、特異性を付与する TCR遺伝子治療法や、がん細胞表面を認識する抗体の遺伝子を T細胞に導入した CAR-T細胞治療法が開発された。現在 CD19 CAR-T細胞療法が前駆B細胞急性リンパ芽球性白血病に対する治療法として認可されている。ただ、これら共通の問題点として GMP grade で T細胞を培養し遺伝子導入する必要があることから 1ショット当たりの医療費が大変高くなることが挙げられる。それでも CAR-T治療のように1ショットで非常に強い抗腫瘍効果を発揮できるのならば多くの患者に応用が可能かもしれない。CAR-T細胞の利点としては、がん細胞の細胞表面を認識するため、がん細胞の HLA に非依存的である点である。そのため例えば HLA の低下によって免疫逃避しているがん細胞には非常に有効であろう。弱点としては、がん抗原分子を一つしか狙い撃ちできないため、その抗原を脱落したがん細胞が耐性を獲得する可能性がある。
PD-1抗体治療により、ヒトにおいても免疫監視機構が存在することが証明された。残された重要な課題は、1) PD-1抗体治療に対する不応答性の機序を解明すること、2) その理論的根拠に基づいた有効な併用療法の開発と、3) 治療効果予測バイオマーカーの同定である。現在、PD-1抗体治療ベースに様々な併用治療の試みが行われている。その中には、これまで単独では効果が少なく、認可にまでは至らなかったがん抗原ワクチン治療や、自然免疫を中心とした免疫アジュバンド治療が見直され、併用することにより免疫チェックポイントの効果を増強する研究が盛んに進んでいる。
多くの研究では、不応答性の原因として主に腫瘍側の因子が探索されているが、今後免疫側の個人差に関わる要因についても研究が進むであろう。腫瘍側に注目した併用治療として、現在臨床試験が行われているものは、化学療法、放射線治療、血管新生阻害治療等があげられる。一方で免疫側に着目して進められている併用治療として、Lag-3、Tim3、VISTA等の他の免疫チェックポイント分子阻害剤、GITR、4-1BBや OX-40等の補助シグナル分子活性化剤と PD-1阻害剤の併用治療の治験が行われている(6)。
現時点ではまだ免疫チェックポイント阻害剤は非常に高価な治療薬であるが、多くのがんに保険適応されつつある。しかし、がんの多くは高齢者に発症するため、少子高齢社会である日本では医療費の圧迫が社会問題になっている。本治療法に対して無効である患者と有効である患者を見分けることができると、医療費の削減につながるだけでなく患者の治療の選択肢の拡大にもつながるため、有効と無効を見分けるバイオマーカーの同定は急務である。有効性の最も高いものを残すべきであるが、バイオマーカーに関しては、排除するのではなく融合すればするほど予想効率が上がると考えられる。知財等の問題から企業間におけるバイオマーカーの融合は簡単ではないが、これらを融合し臨床現場へ届けることのできるシステム構築が必要である。
前述した様にバイオマーカーの主な考え方として、腫瘍側の因子と免疫側の因子に分けて考える必要がある。免疫側の因子としては、腫瘍局所における CD8+ T細胞の浸潤数が挙げられ、腫瘍側の因子としては、PD-L1 の発現や腫瘍の遺伝子変異の数 (neo-antigen) など、いくつかの有望なバイオマーカーが挙げられる。しかし、それぞれのバイオマーカーだけで完全に有効性を予測することは難しいのが現状である。抗腫瘍免疫反応を規定する因子は 図1 に示すように数多く存在し複雑である。例えば、一見免疫とは無関係に思える腸内細菌や代謝産物等も免疫反応に大きく関わっていることが明らかになってきた(7,8)。抗腫瘍免疫反応を正確に予測するには、免疫と他の高次統御機構を考慮し、分野横断的に研究を進めていく必要がある。現在、上述したように多くの併用治療が開発されつつある。併用治療は副作用が少なく、有効性の最も高いものを残すべきであるが、バイオマーカーに関しては、排除するのではなく融合すればするほど予想効率が上がると考えられる。知財等の問題から企業間におけるバイオマーカーの融合は簡単ではないが、これらを融合し臨床現場へ届けることのできるシステム構築が必要である。
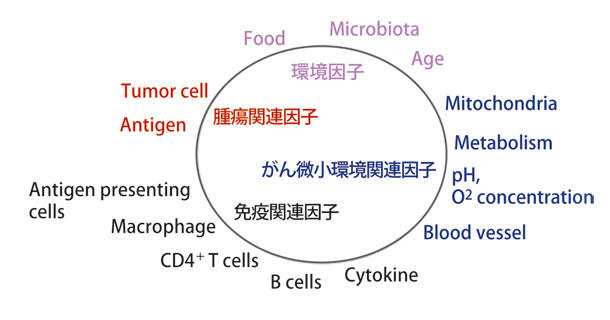
図1 抗腫瘍免疫反応は様々な因子によって制御されている
現在、併用治療を含めると3千以上ものPD-1阻害抗体を中心としたがん免疫治療の臨床試験が行われている (ClinicalTrials.gov)。5〜10年後には様々な腫瘍に対して、最適の併用治療が選択され、治療効率はさらに上がるものと予想される。現在行われている併用治療の試みは、免疫反応制御の理論に基づいたものから、ただ既存治療法と併用したものが混在した状態である。本来ならば開発の順番は前者であるべきである。しかし後者も多く行われているのが現状であり、その場合、臨床試験の実施と結果が先に実証され、なぜPD-1抗体治療法の効果が増強されるかという理論は追って解明されることになるであろう。予想されることは、治療効果(増強効果)の高い治療法が生き残り、治療効果の低い併用治療法は淘汰されていくことである。奏効率の高い新規併用治療が登場すれば、それに対する効果予測(患者選別)バイオマーカーも必要になることが予想され、バイオマーカー研究も併用治療の変化に応じてどんどん変遷していくものと考えられる。一方で、新規併用治療法によりPD-1阻害抗体治療でみられる副作用、immune relatedadverse event (irAE) が増強される可能性もあり、今後の irAE に関連する研究もますます重要になってくるであろう。併用治療による不測な副作用を心配するより、PD-1阻害抗体単独で効く患者には単独治療の方がいいという考え方も依然あり、やはり PD-1阻害治療単独の奏効者、無効者を見分けるバイオマーカーの開発は重要であるとも考えられる。現在様々な製薬企業が競って免疫チェックポイント阻害薬を開発しており、がん腫適応範囲の拡大、様々な併用治療の開発の現状を鑑みると、一定の落ち着きが見られるまでまだまだ時間を要することになると思われる。
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について
© COSMO BIO