μ/ω-TRTX-Tap1aは、生物学的活性を有した高純度の合成ペプチド毒素です。
電位依存性Na+およびT型Ca2+チャネルのブロッカーです。
電位依存性Na+およびT型Ca2+チャネルのブロッカーです μ/ω-TRTX-Tap1a
背景
μ/ω-TRTX-Tap1a(Tap1a)は、タランチュラ(Theraphosa apophysis)の毒から単離された35アミノ酸のペプチド毒素です。Tap1aは、過分極を引き起こすことで、電位依存性ナトリウムチャネル(NaV)および電位依存性カルシウム3チャネル(CaV3)の活性化および定常状態の不活性化を阻害します1。
Tap1aは、NaV1.7、NaV1.2、CaV3.1をナノモル濃度で、NaV1.3、NaV1.6、NaV1.1、CaV3.2を低ミクロモル濃度で特異的に阻害することが知られています1。これらのイオンチャネルは、神経細胞の分極、体性感覚の伝達、神経細胞の分化、死、生存に関与しているため、疼痛疾患、てんかん、加齢に伴う神経変性など、多くの疾患にも関連しています。
クモ型ペプチドは、様々なイオンチャネルや受容体タンパク質を調節します。クモ型ペプチドのサブタイプであるKnottinは、インヒビターシスチンノット(ICK)ペプチドとも呼ばれています。ICKペプチドは、ジスルフィドに富んだ構造モチーフを持ち、「結び目」を形成することで、構造的、熱的、そしてタンパク質分解的に高い安定性をもっています。Tap1aのモデリングされた構造から、クモ毒ペプチドに典型的なICKフォールドと、クモ毒ペプチドとCaV3やNaVチャネルとの結合に関与する疎水性パッチが発見されました1。
CaV3はT型の低電圧ゲート型カルシウムチャネルです。電気生理学的な特性は、低電圧で活性化・不活性化する閾値、急速な不活性化、rebound burstingなどがあります。これらの特性により、中枢神経系や末梢神経系において、神経細胞の興奮を細かく制御しています2。
CaV3.1は、脳の扁桃体、視床下核、小脳、視床で高発現している一方、心臓では中程度にしか発現していません。CaV3.1は、神経細胞の分極、シナプス伝達、神経細胞の分化、死、生存に関与していることが知られています。CaV3.1は、加齢に伴う神経変性、パーキンソン病、アルツハイマー病のプロセスに関連があると示唆されています3。さらに、CaV3.1の変異は小脳性運動失調を誘発することが明らかにされています。CaV3.2チャネルは視床に発現しており、てんかんの病態生理に関与しています。また、CaV3.2遺伝子を構造的に欠失させると、マウスの急性痛、炎症性痛、慢性内臓痛が緩和されることが分かっています4。
NaV1.1-1.9 は電位依存性ナトリウムチャネルです。膜の脱分極に伴い開口し、膜の過分極に伴い速やかに不活性化され閉じた状態に戻ります。Na+イオンの急速な流入は、活動電位の発生・伝播や体性感覚シグナルの伝達に不可欠です。
NaV1.7 は、PNS、後根神経節ニューロン、内臓感覚ニューロン、嗅覚ニューロン、三叉神経節、交感神経ニューロンに発現しています。NaV1.7のgain-of-function変異は、遺伝性紅痛症(IEM)、発作性極度疼痛症(PEPD)、小神経線維症(SFN)、有痛性糖尿病性末梢神経障害など、様々な疼痛疾患の患者において確認されています5。
NaV1.2は、発生初期にランビエ絞輪と軸索起始部(AIS)に多く発現しています。NaV1.2は、活動電位の開始と伝播に主要な役割を果たしています。成熟した神経細胞では、NaV1.6が活動電位開始の役割を担い、NaV1.2は活動電位を増大させるだけであることが分かっています。NaV1.2の病原性変異体は、反復発作性運動失調症、統合失調症、自閉症スペクトラム障害、発作を伴うまたは伴わない知的障害などの神経発達障害の一般的な原因となっています6。
製品情報
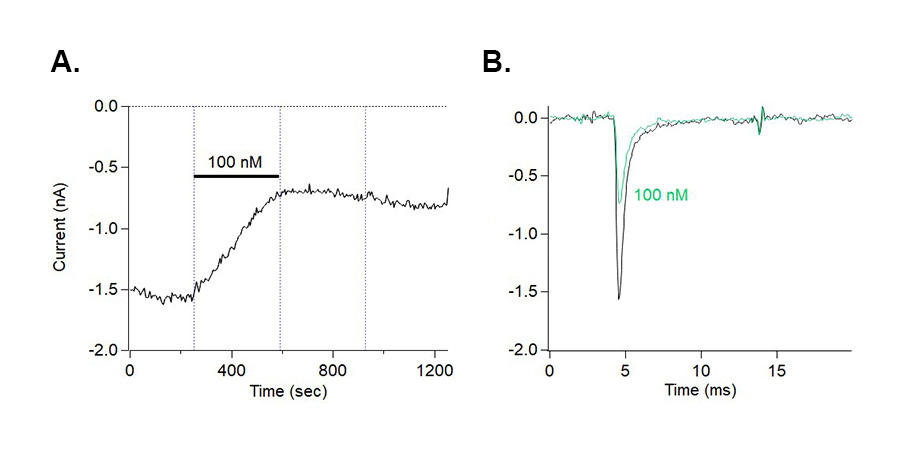
図1:μ/ω-TRTX-Tap1a(品番:STT-600)は、HEK293安定発現細胞株における NaV1.7チャネル電流を阻害する
- μ/ω-TRTX-Tap1a(品番:STT-600)によるNaV1.7チャネル電流の阻害の代表的なタイムコース(n=6)。膜電位を-100 mVに保持し、5秒ごとに0 mVまで10 msの電圧ステップで電流を誘発し、100 nMのμ/ω-TRTX-Tap1aの適用により有意に抑制された。
- 100 nM μ/ω-TRTX-Tap1a 非存在下(対照)および存在下(緑)における NaV1.7チャネル電流の重畳トレース(A の記録から採取)。
| 由来 | Theraphosa apophysis(Goliath pinkfoot tarantula)(Pseudotheraphosa apophysis) |
|---|---|
| 分子量 | 4182.7 Da |
| 配列 | DDCLGMFSSCDPNNDKCCPNRKCSRKDQWCKYQLW-OH |
| 修飾箇所 | ジスルフィド結合の場所: Cys3-Cys18, Cys10-Cys23, Cys17-Cys30 |
| ペプチド含有量 | 100% |
| 純度 | >98% |
| 分子式 | C174H258N52O55S7 |
| 形状 | 凍結乾燥粉体 |
| Accession number | P0DQO3 |
| Source | 合成ペプチド |
| ターゲット | NaV channels and T-type Ca2+ channels |
|---|---|
| 有効濃度 | 80 nM - 1 µM |
| 活性効果 | NaV1.1, NaV1.2, NaV1.3, NaV1.6, NaV1.7 および CaV3.1 ブロッカーとしてナノモル濃度(IC50=81-301 nM)で作用。NaV1.3の速い不活性化を選択的に遅らせる。また、CaV3.2に対しても中程度の阻害効果を示す(IC50=1233 nM)1. |
- Cardoso, F. C. et al. (2021) Pain 162, 569.
- Lory, P. et al. (2020) Pflugers Arch-Eur. J. Physiol. 472, 831.
- Pan, C. et al. (2021) Curr. Med. Sci. 41, 680.
- Candelas, M. et al. (2019) Sci. Rep. 9, 3112.
- Dongol, Y. et al. (2019) Toxins 11, 626.
- Reynolds, C. et al. (2020) Eur. J. Paediatr. Neurol. 24, 117.
μ/ω-TRTX-Tap1a
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
μ/ω-TRTX-Tap1a |
ALO | STT-600 | 50 UG |
¥66,000 |
μ/ω-TRTX-Tap1a |
ALO | STT-600 | 0.1 MG |
¥103,000 |
μ/ω-TRTX-Tap1a |
ALO | STT-600 | 0.5 MG |
¥211,000 |
μ/ω-TRTX-Tap1a |
ALO | STT-600 | 1 MG |
¥291,000 |
μ/ω-TRTX-Tap1a |
ALO | STT-600 | 5 MG |
お問い合わせ |
μ/ω-TRTX-Tap1a |
ALO | STT-600 | 10 MG |
お問い合わせ |
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について
- 「μ/ω-TRTX-Tap1a」は、下記のカテゴリーに属しています。























 このページを印刷する
このページを印刷する