|
田村 律人 様 東京大学大学院 医学系研究科 分子生物学分野 水島研究室 |
抗LC3 抗体を用いた蛍光免疫染色法による
内因性LC3 の検出例
ユーザーレポート
Products
メーカー:コスモ・バイオ株式会社
実験内容
オートファジーは主要な細胞内タンパク質分解系の一つである。栄養飢餓などのオートファジー誘導条件下では、隔離膜と呼ばれる膜構造体が形成される。隔離膜は細胞質の一部 を取り囲みながら伸長し、末端が閉鎖することで二重膜のオー トファゴソームが完成する。オートファゴソームはリソソームと速やかに融合し、オートリソソームへと成熟する。隔離された細胞質成分はリソソーム内に含まれる分解酵素により分解される(図1)。
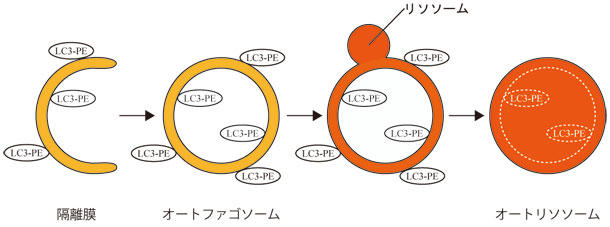
図1. オートファジー模式図
隔離膜が伸長し、末端が閉鎖するとオートファゴ ソームと呼ばれる二重膜構造体が形成される。オートファゴソームがリソソームと融合すると、リソソーム内の分解酵素によって隔離した内容物が分解される。LC3 はホスファチジルエタノールアミン (PE) と共有結合した LC3-PE として、隔離膜及びオートファゴソーム膜、一部のオートリソソーム膜上に局在する。
オートファゴソームの形成にはオートファジー関連 (autophagy-related: ATG) タンパク質群が関与しており、そのうちのひとつに microtubule-associated protein 1 light chain 3 (LC3) がある。LC3 はユビキチン様修飾により、ホスファチジルエタノールアミン (PE) と共有結合した状態で隔離膜及びオートファゴソーム膜に局在化する (LC3-PE)。そのため、LC3 はオートファジー関連膜のマーカータンパク質として、広く利用されている。
遺伝子導入による GFP-LC3 の検出が頻繁に行われているが、遺伝子導入を行わなくても、蛍光免疫染色法によって内因性 LC3 を検出することが可能である。実例として、マウス胎児線維芽細胞における内因性LC3の検出結果を示す(図2)。血清及びアミノ酸を含まない培地(飢餓培地)で培養した野生型細胞では、富栄養条件と比べ、ドット状のシグナルが顕著に増加する。一方で、LC3のPE化が起こらない Atg3 欠損細胞では、飢餓培地で培養してもドット状シグナルが観察されない。従って、ドット状シグナルは隔離膜及びオートファゴソーム膜に局在する LC3-PE を表しているといえる。また同様の方法はマウス由来の細胞だけでなく、ヒト培養細胞(HeLa 細胞)でも可能である(1)。蛍光免疫染色法に加え、免疫電子顕微鏡法で内在性LC3 を検出することもできる(2)。
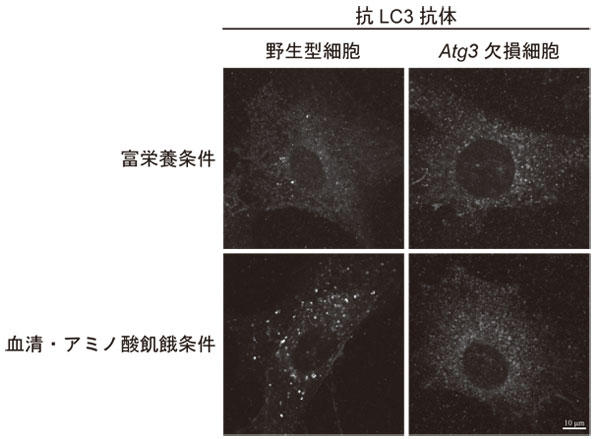
図2. マウス胎児線維芽細胞の内因性LC3 蛍光免疫染色画像
野生型及び Atg3 欠損細胞を富栄養培地または血清・アミノ酸不含有培地で1 時間培養後、4% パラホルムアルデヒド固定した。固定した細胞を50 µg/mL ジギトニンで5 分間透過処理し、抗LC3 抗体 (CTB-LC3-2-IC Clone: LC3-1703, Cosmo Bio) と1 時間、Alexa488 標識二次抗体と1 時間反応させて染色した。スケールバー(白線)は 10 µm を表している。
LC3 はマーカータンパク質として有用であるが、オートファジー活性の解釈には注意が必要である。リソソームの障害などによりオートファゴソームの成熟や消費が抑制された場合、 細胞内にオートファゴソームが蓄積し、LC3 のドット状シグナルも増加する。そのため LC3 のドット状シグナルの増加だけでは、オートファジーによる分解が亢進しているかどうか は判断できない。それを知るには、オートファジーのフラックスを計測する必要がある(3)。また、LC3はオートファゴソーム膜だけでなく、隔離膜や一部のオートリソソームにも局在する。そのため LC3 陽性の構造体の正体をより正確に知るためには、隔離膜にのみ局在する他のATG タンパク質(ATG5 など)やリソソームマーカータンパク質との共局在観察が必要である。
GFP-LC3 を用いたオートファジーの観察は、簡便でありかつ生細胞解析が可能となるなどの多くの利点がある。しかし、GFP-LC3 の高発現そのものがタンパク質凝集を引き起こした り、動物実験ではGFP-LC3 発現動物との交配が必要になったりと、注意すべき点や不便な点もある。内因性LC3 の検出はそれらを回避できる方法であり、実験の応じて適切な方法を 用いることが必要であると考えられる。
参考文献
- A. K. Velikkakath, T Nishimura, E. Oita, N. Ishihara and N Mizushima. Mammalian Atg2 proteins are essential for autophagosome formation and important for regulation of size and distribution of lipid droplets. 2012. Mol. Biol. Cell, 23: 896-909.
- Kishi-Itakura, I. Koyama-Honda, E. Itakura and N. Mizushima. Ultrastructural analysis of autophagosome organization using mammalian autophagy-deficient cells. 2014, J Cell Sci., 127: 4089-4102.
- N. Mizushima, T. Yoshimori and B. Levine. Methods in mammalian autophagy research. 2010, Cell, 140: 313-26























 このページを印刷する
このページを印刷する