- 【01】 ChIPの成功には、クロマチンの質が重要です。
- 【02】 クロマチンは常に、氷上で保管してください。
- 【03】 固定され過ぎた細胞は、溶解及びせん断しにくくなります。
- 【04】 固定液は新鮮なものを使用してください。
- 【05】 ご自身の細胞に対し適切なせん断方法(ソニケーションまたは酵素反応)を 選択してください。 細胞によっては、酵素消化が困難なものもあり、ソニケーションが必要です。
- 【06】 クロマチンは100-500 bpになるようにせん断してください。 せん断のし過ぎは、ChIP効率を減少させます。
- 【07】 ChIPにバリデードされている抗体をご使用ください。 バリデートされていない抗体は、上手くいかない場合があります。
- 【08】 ポジティブ及びネガティブコントロール抗体と一緒に実験を行ってください。
- 【09】 抗体とクロマチンの比を正しくしてください。
- 【10】 細胞の溶解バッファーを最適化してください。溶解バッファーが多すぎると抗体の結合を干渉します。
質の悪いクロマチン=質の悪いChIP結果
ChIPアッセイの成功は、クロマチン調製の質に大きく依存します。クロマチン調製における3つの最重要ステップは、溶解、固定、せん断です。各ステップは、完全に最適化される必要があります。
クロマチンは、室温で保存または操作をすると、とても早く分解されます。良い結果を得るために、クロマチンは実験中、氷上に置いてください。凍結融解は避けてください。小さな量で分注し、クロマチンストックを調製しておくことで、分解を避けることができます。Chromatrap® は、IPに必要なクロマチン量はとても少ないため、小さな量で分注することが望ましいです。
クロマチンの質を良くするため、細胞固定の最適化は必須です。細胞の固定のし過ぎは、溶解及びせん断しにくくなり、クロスリンク効果を減少させます。これは、下流のシグナルを制限します。Chromatrap® は、1%ホルムアルデヒド/培地または1%ホルムアルデヒド/PBSで細胞を10分間室温、回転式プラットフォーム上で固定することができます。収率が悪いようであれば、5分でも十分かもしれません。
クロマチン調製のホルムアルデヒドは、毎回新鮮なものを使用してください。再現性のある結果を得ることができます。メタノールは細胞膜を破壊するため、ホルムアルデヒドがメタノールフリーであることに気を付けてください。
ソニケーション(ウルトラソニックを使用した機械的せん断)と酵素(ミクロコッカスヌクレアーゼ消化)によるせん断方法はどちらも使用できます。最も重要なことは、適切な方法を選択することです。Chromatrap® は、どちらかの方法を備えたスタンダードChIPキットです。Porvair社ではクロマチンの最適化のためのスタンダードのみの酵素消化キットも取り扱っています。
酵素によるせん断は、ソニケーターがない場合に便利です。抗体で認識される興味のあるタンパク質のエピトープを破壊してしまうリスクが軽減されます。しかしながら、特異的に切断されるヌクレアーゼ配列によりバイアスを創出します。溶解に耐性のある細胞タイプの場合においては、ソニケーションがせん断と溶解を助けることになります。酵素によるせん断は、ネイティブChIP(クロスリンクしていないクロマチン)を調製する場合、ソニケーションでタンパク質/DNA複合体を破壊できるのと同様に不可欠です。
ソニケーションと酵素消化によるせん断の最適化は、前項をご参照ください。
| 利点 | 欠点 | |
|---|---|---|
| ソニケーション | ・ランダムな断片化 ・溶解が困難な細胞タイプに適している |
・ 乳化やオーバーヒートによって、エピトープがダメージを受ける可能性あり ・高価な機器が必要 ・ネイティブクロマチンの調製に使用できない |
| 酵素処理 | ・軽度な処理なので、エピトープへのダメージが少ない ・高価な機器が必要でない ・ネイティブクロマチンの調製に適している |
・酵素によって消化されやすい配列によるバイアスがかかる ・溶解が困難なサンプルには適さない |
クロマチンの調製では、毎回クロマチンが100-500 bpのフラグメントにせん断されていることを確認してくださ い。クロマチンの定量分析は、分光光度計、蛍光計、マイクロ流体プラットフォームを用いて行います。定性分析には、アガロースゲルまたはマイクロ流体プラットフォームが必要です。Chromatrap® は、DNAの定量化を精密で理想的な Chromatrap® バッファーシステムとの適合性を示すマイクロ流体プラットフォームで行われることを推奨します。
クロマチンのせん断のし過ぎは、結果としてプライマーが認識しにくいとても小さな断片となり、PCR効率がとても下がってしまいます。ソニケーションによるせん断のし過ぎは、タンパク質のエピトープにダメージを与えるリスクを増大させます。せん断が不十分であると、大きなフラグメントとなり、ChIPにおいて非特異的結合を増大させます。ソニケーション効率は、細胞タイプによって変化し、またサンプルのクロスリンクの広がり、加熱、乳化状態によっても影響を受けます。ソニケーションを最適化することはChIPの結果を成功させる上で重要です。柔らかいプラスチックチューブを使用するよりも超音波伝導の良い硬いプラスチックでできたソニケーションチューブを使用してください。十分な細胞株や組織サンプルを準備して、最適化を始めてください。これは、出力の設定やサイクル数を含むご自身のソニケーターの異なるパラメーターを最適化するのに必要です。Chromatrap® の手順では、細胞株や初代培養細胞の良いせん断は、100-500 bpのフラグメントサイズになるように調製することで、4℃のウォーターバスを使用し、ソニケーターで30秒間処理し、30秒間のインターバルを挟みます。出力は、3に設定し、15分間行います。
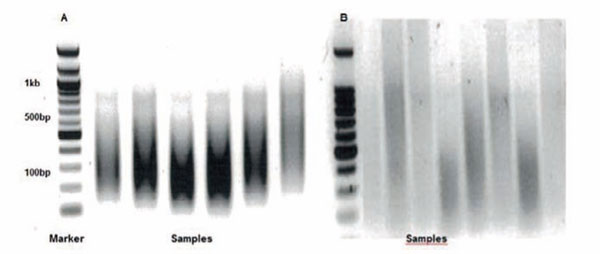
図1 ソニケーションの最適化とクロマチン断片の長さ
(A): 最適なソニケーション条件で、せん断されたクロマチンの電気泳動。クロマチン断片の長さは100〜500 bpに揃っている。
(B): 適切でないソニケーション条件で、せん断されたクロマチンの電気泳動。クロマチンの断片は、拡散し、スメアになっている。
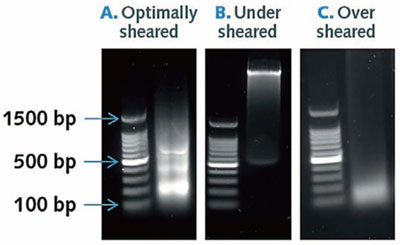
図2 せん断の最適化とクロマチン断片の長さ
(A):正しい酵素消化が行われたクロマチン断片の長さ。フラグメントのサイズは200-600 bp。
(B):酵素によるせん断が不十分なクロマチン断片。フラグメントのサイズは、500 bp以上。
(C):酵素によるせん断をし過ぎたクロマチン断片。フラグメントサイズは、200 bp付近になっている。
酵素によるせん断は、細胞膜の溶解と酵素の濃度が最も重要なファクターです。100-500 bpの断片を得るためにクロマチンの比を最適化することは重要です。希釈系列を作り、最適な酵素とクロマチンの比をご自身のサンプルで決定します。酵素の濃度と反応時間を変更し、選択します。Chromatrap® では、1Uに対し、5 ?gのクロマチンを反応させることで、最適な断片の長さになります。せん断が不十分(400 bp以上)の場合、クロマチンに対する酵素ユニットを増やしてください。もし、クロマチンが、せん断され過ぎている(モノヌクレオソーム断片が完全に消化されてしまっている)場合、クロマチンに対する酵素量を減らしてください。
位相差顕微鏡を使用して、酵素消化に移る前に、全ての核がリリースされていることを確認してください。溶解条件を改善しても溶解バッファーによるインキュベート後、細胞が溶解しない場合、ソニケーションの方法に変更してください。
高い質とChIPバリデート済み抗体は、ChIPアッセイを成功させるために必須です。
抗体は、DNAが結合した未変性タンパク質を認識し結合しなければなりません。
ChIPバリデート済みポジティブ及びネガティブコントロールをクロマチン調製に使用することは必須です。
免疫沈降ステップの効率化とクロマチン調製を確実にするために、ポジティブ及びネガティブコントロールをテスト抗体と並行して実験することが重要です。
Chromatrap® premium ChIP kitは、ポジティブ及びネガティブコントロールポリクローナル抗体が含まれています。qPCRに最適化されたプライマーも含まれています。
それらは、Glyceraldehyde 3-phosphate dehydrogenase(GAPDH)を認識し、ハウスキーピング遺伝子で (Barber et al., 2005)、クロマチンの調製と方法を最適にすることを確かにします。
あるいは一次抗体を含まない'mock' ChIP反応はバックグラウンドレベルを決定するためのコントロールとして使用できます。抗体コントロールに加えて、ポジティブ及びネガティブ遺伝子ターゲットは抗体による濃縮が特異的であることを確かにする良いコントロールとなります。
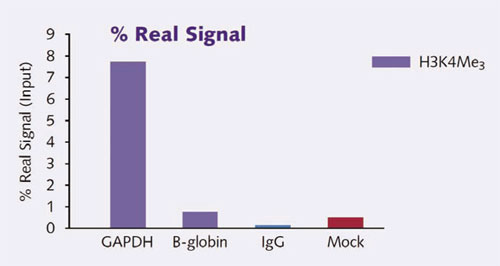
Chromatrap® を使用して、ポジティブハウスキーピング遺伝子GAPDH3上のH3k4Me3の高レベルでの濃縮(7.7%のリアルシグナル)が観察された。ネガティブターゲットのβ-Globinは、H3k4Me3の濃縮はほとんど見られなかった(0.7%リアルシグナル)。
IgGや抗体なし(mock)コントロールもそれぞれ、0.15%、0.38%のリアルシグナルで、Chromatrap® ChIPアッセイの特異性と感度が良いことが分かる。リアルシグナルのパーセンテージは、非特異的IgGの非特異的結合によって生じたシグナルを使用して標準化し、インプットされたクロマチンの割合として計算された。
ChIPアッセイにおいて、抗体とクロマチン比は重要です。正しくない比によって、シグナル/ノイズ比が落ちる可能性があります。抗体が多すぎる場合、飽和し、そのChIPアッセイは非特異的な結合を誘導します。抗体が少なすぎる場合、全てのクロマチンが結合できず、抗体が上手く働かずサンプルの濃縮が不十分になる可能性があります。
マグネティックやアガロースビーズは、抗体結合効率が変化することで知られています。
Chromatrap® は、固有の固相プラットフォームで、抗体の結合する表面積を大きくし、分子の混合を促進し、非特異的なバックグラウンドを最小限にします。
Chromatrap® 技術は、非常に少ない量(50 ng - 7 ?g)のクロマチンをIPに用いることができます。
クロマチンの量が少ない場合は、抗体:クロマチン=2:1が最適で、クロマチンのローディング量が5 ?gより多いときは、1:1が最適です。抗体の使用量を抑えることが可能です。最適な比を決定するためにご自身のChIPアッセイのサンプルを処理する前に、抗体希釈系列を作り試験することが重要です。
溶解バッファーは通常、冷たい温度で液体の中に沈殿が生じる緩やかな界面活性剤を含んでいます。ChIPアッセイにおいて、細胞溶解の溶解バッファーの最適化を確かにするため、使用前に40℃で時折撹拌しながらもしくは転倒混和し温めて沈殿を溶かす必要があります。
溶解ステップにバッファーを使用するときは室温に戻してください。また、全ての沈殿を確実に溶解してください。 溶解バッファーの量は、クロマチンを調製する際に重要です。細胞の数が少ない場合(1-5×10^6)は、細胞が多いとき (1-1.5×10^7)よりもライシスバッファーの量を少なくしてください。溶解バッファーが多すぎる場合、余分な界面活性剤が抗体結合能を阻害し、その後の分析にも影響を与えます。余分な溶解バッファーは、結果としてクロマチンサンプルの濃縮率が悪いことにもつながります。クロマチン調製において、ChIPアッセイの前に溶解バッファーの量を最適化することを確実にしてください。Chromatrap® キットは、スタートの細胞数に合わせて溶解バッファーの量が最適化されています。下記テーブルをご参照ください。
| バッファー | 細胞数(×10^6) | 量(mL) |
|---|---|---|
| 0.65M Glycine | 1-5 | 3 |
| 5-10 | 4 | |
| 10-15 | 5 | |
| Hypotonic buffer | 1-5 | 0.4 |
| 5-10 | 0.8 | |
| 10-15 | 1.0 | |
| 溶解バッファー | 1-5 | 0.3 |
| 5-10 | 0.3-0.5 | |
| 10-15 | 0.5-1.0 |






















