FLICA? FAQ
- 【01】 感度はどのくらいですか?
- 【02】 操作にはどのくらい時間がかかりますか?
- 【03】 「1テスト」の定義は?
- 【04】 必要な試薬量はどのくらいですか?
- 【05】 波長について教えてください。
- 【06】 固定化細胞あるいはパラフィン包埋細胞に使用できますか?
- 【07】 凍結細胞で使用できますか?
- 【08】 細胞の洗浄方法を教えてください。
FLIVO? FAQ
- 【01】 40μL以上を動物に注射できますか?
- 【02】 1バイアルで動物何匹分の実験ができますか?
- 【03】 FLIVO?を静脈投与ではなく腹腔投与できますか?
- 【04】 なぜ30-60分の還流が必要なのですか?
- 【05】 どのくらいでFLIVO? はなくなりますか?また、どこへ行きますか?
- 【06】 マウス以外の動物にFLIVO? を使用できますか?
- 【07】 組織サンプルはどのように検出するのですか?
- 【08】 ウインドウチャンバーシステムは市販していますか。
- 【09】 どのくらい蛍光シグナルは持続しますか?
- 【10】 動物を還流させることができますか?
- 【11】 他の標識を一緒に行うことができますか?
- 【12】 FLIVO? は神経あるいは癌に特異的ですか?
- 【13】 FLIVO? は血液脳関門を通過しますか?
- 【14】 FLIVO? は血液網膜関門を通過しますか?
- 【15】 FLIVO? は細胞内に浸入しますか?
- 【16】 バックグラウンド蛍光はありますか?
FLICA? FAQ
とても高感度です。コントロール細胞に自然発生するアポトーシス(2-6%の細胞数)でさえも検出します。アポトーシス陽性細胞のアポトーシスはコントロール細胞の2-15倍です。
この試薬は細胞に添加後15分以内に反応を開始し、72時間までは細胞を死なせることなくインキュベーションすることができます。一般的にはインキュベー ション時間は1-4時間で、実験を一日で終わらせることができます。正確なインキュベーション時間は研究者の実験プロトコールに従って決定してください。
一般的には、1テストとは蛍光プレートリーダー上で試験する300μLの細胞培養液を指します。サンプルによっては、これは異なります。たとえばこのキット は蛍光顕微鏡観察の目的にはごく少量の細胞が必要であり、フローサイトメトリー解析には1x106cells/mLが必要です。
この試薬は安定化した凍結乾燥粉末として供給されています。約50μLのDMSOをこの試薬バイアルに加えて溶解させ、PBS 300μLで希釈し、この溶液から10μLとって研究対象の細胞に加えます。細胞種によっては加える試薬量を調節する必要があります。このキットは加える 試薬量を調節したり、またインキュベーション時間を長くしたりすることでカスタマイズできます。
FLICA kitは固定化細胞には使用できませんし(ただし、ラベル後の細胞固定は可能です。)、パラフィン包埋細胞にも使用できません。カスパーゼ酵素が不活性化する可能性がありますのでお勧めできません。
FLICA? は条件により、凍結切片や凍結細胞にて作用できます。本試薬は、細胞膜が無傷なままであることが必要条件となります。しかしながら、凍結を行うとしばしば 膜にポアを形成し、そこから蛍光シグナルが放出される可能性もあります。凍結切片のTotal蛍光シグナルをプレートリーダーにて測定する場合は、 Magic Red? キットが最適です。
FLICA? キットでは、非結合の試薬(バックグラウンド)を取り除くため、洗浄操作が必要です。試薬とインキュベーションをした後、培地を取り除き新しい培地あるい はIMT社の洗浄バッファーでスピン操作を行います。接着細胞はプレート上で行います。スピン操作ができない場合あるいは遠心分離に細胞が耐えられない場 合は、培地を新しい培地あるいは洗浄液に取替え、1時間インキュベーションして非結合の試薬を拡散除去してください。この洗浄液を取り除いて細胞を解析します。
FLIVO? FAQ
はい。インジェクションバッファーを多く使用してストック濃縮試薬を希釈してください。その後希釈液量を6分割してください(各バイアルがマウス6匹分の試 薬を含むため)。例えば、50μLのDMSOでFLIVO? を溶解し、インジェクションバッファー550μLでこれを希釈します。これによりインジェクション溶液が600μLできあがりますので、マウス1匹あたり 100μLを投与してください。
1vial当たり6匹分のマウス(体重30g)に使うことができます。それよりも大きい動物には多めに試薬を使用してください。IMT社では他の実験動物1体あたりのFLIVO試薬必要量は算出していません。
腹腔投与はおすすめしません。FLIVO試薬が簡単に細胞にアクセスできないからです。腹腔投与または、組織の部位に投与する場合は、試薬がアポトーシス細胞の近くのいくつかの層を通って浸透しますが、ターゲット組織全てには浸透しないでしょう。静脈注射ではなく部分的な投与を行う場合は、実験を複数回行うようにしにてください。IMT社では、FLIVO?がもっとも効果的に作用するのは実験動物の血流を通してであるという結果を得ています。
還流を行っている間、血流システムの拍動と共に細胞に試薬が出入りします。FLIVO? は細胞透過性で細胞膜を自由に通過します。細胞に活性型カスパーゼが存在すると、試薬がカスパーゼと共有結合し、細胞内にとどまります(大きな分子になる ため、細胞膜を通過できなくなるためです)。細胞に活性型カスパーゼがなければ、未結合のFLIVO? は細胞から排泄され、体内循環を続けます。FLIVO? は約1時間で体内循環から排除されます。循環を60分以上行う必要はありません。循環後、カスパーゼ陽性細胞は蛍光シグナルを弱く発しながら壊れ始めます。30-40分後には、最適量の蛍光を観察することができます。60分間循環を行うことで、非特異性のバックグラウンドシグナルを減らします。
FLIVO? は1時間で体内全体に循環し、アポトーシス細胞と結合しなかった細胞は肝臓や腎臓でろ過されてなくなります。詳細な経路についてはさらなる調査が必要です。
緑と赤色の蛍光を検出します。ウインドウチャンバーシステムを用いる場合は直接組織を観察できます。あるいは、組織を摘出して蛍光顕微鏡で観察したり、フ ローサイトメーターで細胞死を定量したりできます。 実験動物そのままの全体像を撮影することもできます。装置については、現在Xenogen社のIVIS機器(動物-全体像撮影装置) を用いて何回かの予備実験を行っており、それによると、無傷のままの動物を通して試薬を検出できることが示唆されています。
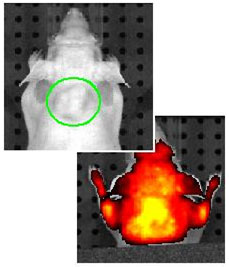
FLIVO? を用いて無傷の生きた動物でアポトーシスを観察 ヒ ト大腸癌(COLO205 cells)をメスのヌードマウスに注入。27日後 TRAIL (25 mg/Kg)で処理し(右 左はコントロール)、その後、SR- FLIVO?をインジェクト。TRAILを含んだ側では1時間以内にアポトーシスが、観察され、4時間後(右)〜24時間(データは示していない)でアポ トーシスが顕著に高まっていることが示された。ヒト大腸癌(COLO205 cells)- SR- FLIVO?によって強い蛍光を示している-は死滅している。
データはDr. Peter Lassota, Caliper Life Sciences よりご提供いただきました。/ Xenogen (予備的実験データのためシステムの最適条件は示しておりません).
はい。動物を屠殺し、通常と同じように組織を扱います:動物を還流させ、組織を固定あるいは凍結して薄層切片を作成し、あるいは細胞の場合は懸濁します。操作中は光を避けてください。
はい。FLIVO? は赤および緑の2種類がありますので、2重染色が可能です。FLIVO? はまた、DAPIやGFP、ヘキスト、PI、7-ADDのような他の蛍光色素と一緒に使用できます。また、FLIVO? 標識細胞を用いてWBを行うこともできます。操作中は光を避けてください。
いいえ。本試薬は全てのタイプの細胞に出入りすることができます。FLIVO? はカスパーゼ酵素に特異的で、細胞の種類特異的ではありません。神経細胞や癌細胞のみ標識したい場合は、その細胞特異的な他のマーカー等を使用くださ い。(例;神経細胞→Nissl 癌細胞→癌マーカー抗体)
FLIVO? は細胞浸透性物質です。IMT社では、FLIVO?試薬を細胞内に浸入させる目的に最適化しています。細胞を溶解させたり透過性にさせる操作は必要ありません。






















