商品詳細 「特集:ELISpot」
1. 主なエラーのトラブルシューティング
- 【01】 スポットが1つもない
- 【02】 ブランクウェルになってしまった? 何が起こったの?
- 【03】 パッチワークのようなバックグラウンド
- 【04】 端だけにスポットがある
- 【05】 スポットが見えたのに、今は見えない
- 【06】 メンブレンに白いスポットが出現した
- 【07】 暗いELISpot膜になった
2. よくあるご質問(一般)
- 【01】 推奨のELISpotプレートは?
- 【02】 プレートの色は、白色と透明色どちらを選択すべきですか?
- 【03】 なぜELISpot プレートは、エタノールによる前処理が必要なのですか?
- 【04】 エタノール処理のプロトコルは?
- 【05】 どのようにELISpotプレートを洗浄しますか?
- 【06】 "プレコート済" ELISpotプレートとは?
- 【07】 なぜELISA に比べELISpot では、高い抗体のコート量が推奨されるのですか?
- 【08】 どのくらいの時間、ELISpot プレートに抗体をコートすることができますか?
- 【09】 どの細胞タイプがELISpot 分析に適していますか?
- 【10】 凍結細胞はELISpot に使用できますか?
- 【11】 ELISpot アッセイにおいて1 ウェルあたりどのくらいの細胞を入れることができますか?
- 【12】 ヒト血清をELISpot に用いることはできますか?
- 【13】 ALP とHRP コンジュゲートの違いは何ですか?
- 【14】 ELISpot にはどの基質を用いたら良いですか?
- 【15】 なぜ、TMB によるスポットはテスト後から1 日以内に黄色になる、または大部分が消えてしまうのですか?
- 【16】 B-cell ELISpot において、ビオチン化抗原を用いる利点は何ですか?
- 【17】 基質反応後、どのくらいELISpot プレートを置けばよいでしょうか?
- 【18】 刺激無しの細胞が入っていたウェルに小さな非特異的なスポットが見られました。なぜですか?
- 【19】 予測されるELISpot の結果の写真はマブテック社のウェブサイトで見ることができますか?
1. 主なエラーのトラブルシューティング
基質は入れたけれどスポットが現れない。このような状態について理由を解明することは必ずしも簡単なことではありません。以下は、私たちが遭遇した最も多い理由です。
| 失敗内容 | 解決方法 |
|---|---|
| ELISA用基質を使用していた。 | ELISpot用に沈降性基質を使用してください。 |
| サンプルの生存率が低い | 信頼性の高い抗原特異的応答を測定するために、少なくとも 89% の生存率の細胞が必要です。 |
| 最適でないインキュベーション時間 | 分析対象物によってインキュベーション時間は異なります。推奨されるインキュベーション時間については、データシートをご確認ください。 |
| 細胞数が多すぎる - ウェルにコンフルエントコーティングを形成する。 | 抗原特異的T細胞応答を検出するために、通常 250,000細胞を推奨しています。推奨事項は必ずデータシートでご確認ください。 |
- ブランクウェルを 200 µL のPBSで 5回洗浄する。
- 1 µg/mL になるように検出抗体 (0.5% FCS を含むPBS) を添加し、2時間インキュベートする。
- ブランクウェルを 200 µl の PBS で 5回洗浄する。
- SA-ALP (0.5% FCS を含む PBS) を添加し、1時間インキュベートする。
- ブランクウェルを 200 µl の PBS で 5回洗浄する。
- 基質を添加し、10分間インキュベートする。
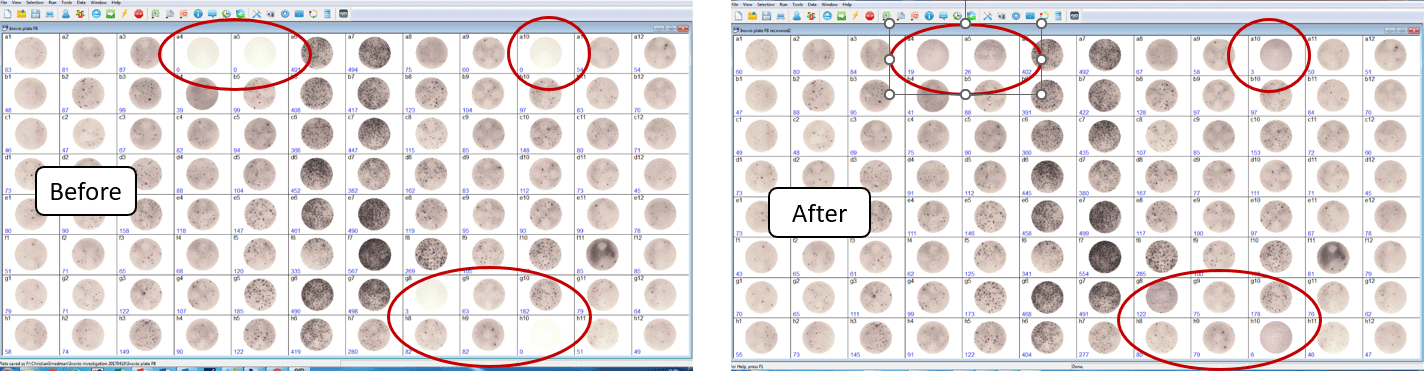
私たちの経験では、ブランクウェルは試薬が添加されていない場合に発生することが多いようです。私たちは皆、人間です。誰にでも起こることです。もう一つのよくある間違いは、ピペッティングエラーです。ウェルに気泡ができると、試薬が底に到達するのを妨げてしまいます。そのため、試薬を添加した後にウェルを点検し、気泡を取り除き、他のウェルと異なるウェルを探す必要があります。ピペットチップでウェルの内壁に触れないように注意してください。幸いなことに、ブランクウェルは右記のリカバリープロトコルで「救出」できる可能性があります。
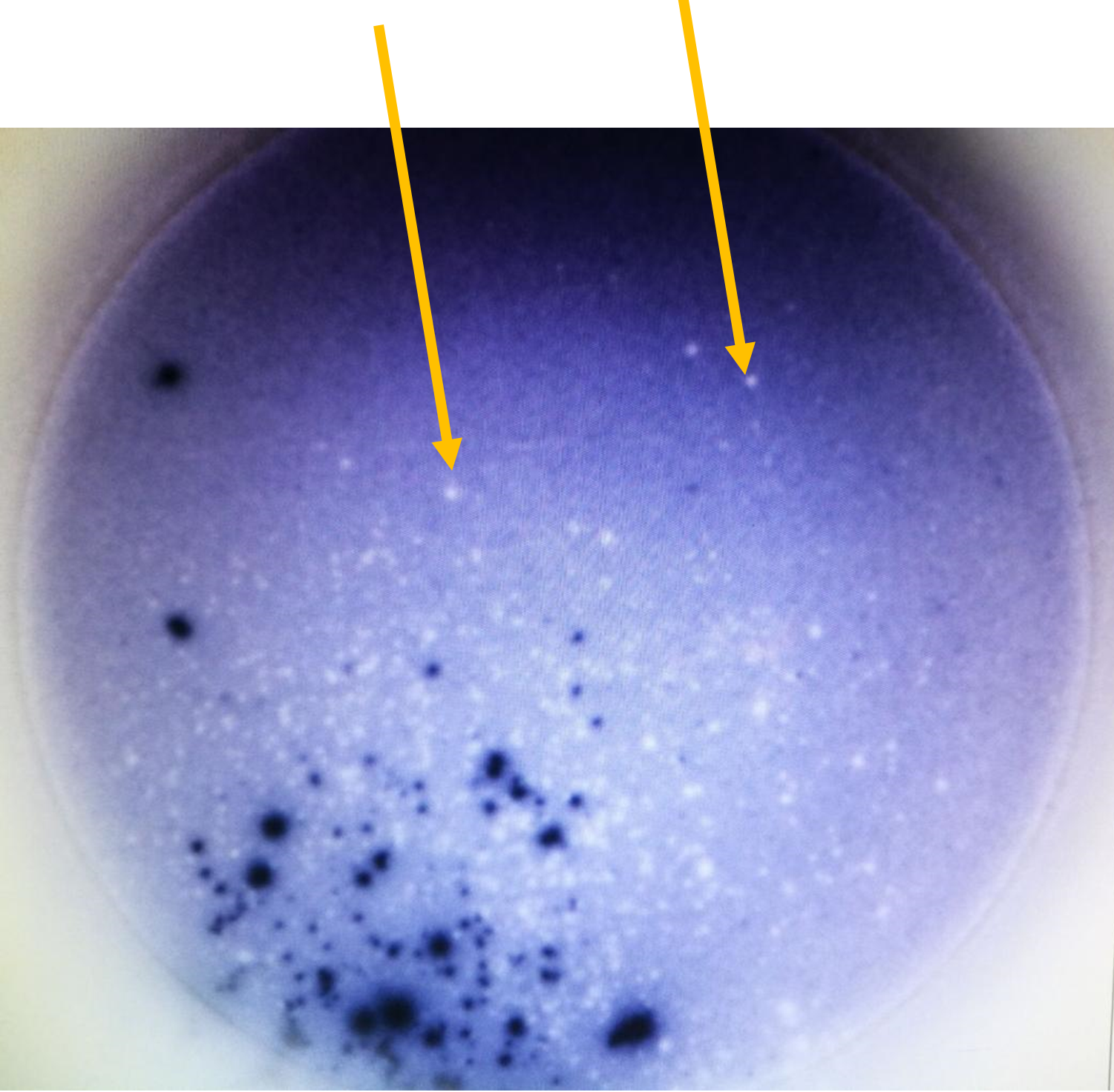
ELISpot のメンブレンが暗く見えることがあります。
- 細胞培養液に含まれるヒト血清が、ウェルが暗くなる原因としてよく知られています。ヒト血清中には、キャプチャー抗体と結合するサイトカインや、異種親和性抗体が含まれていることがあります。FBS への切り替えは、まさに必要な解決策かもしれません。
- Tween は、バックグランドが暗くなるもう一つの一般的な理由です。Tweenはメンブレンを損傷する可能性があるため、ELISpotアッセイに使用することはお勧めしません。
- 以前に活性化された細胞は、ELISpotプレートに加える前に、すでに上清に目的のサイトカインを発現させていることがあります。これは、メンブレンの一般的な黒ずみにつながる可能性があります。細胞を洗浄し、新鮮な培地で再懸濁し、ELISpotプレートに直接移すことが常に良いアイデアです。
- 高濃度の DMSO が、ウェル内のバックグラウンドを暗くさせる可能性もあります。高濃度DMSO は、ELISpotメンブレンをリークさせ、検出抗体をメンブレンの奥まで引き込む可能性があります。このような状況の抗体を洗い流すことは困難であり、プレートの現像時にバックグラウンドが濃くなる可能性があります。DMSO の濃度を 0.5% 以下にすることで防ぐことができます。
2. よくあるご質問(一般)
マブテック社では、96 ウェルのELISpot プレートを推奨しています。PVDF 膜は、キャプチャー抗体が膜に効率よく結合するために、エタノールで前処理すなわち活性化することをお奨めしています。マブテック社は関連商品として複数のELISpot プレートタイプを扱っています。
Plate coating guide をご参照下さい。
白色と透明色のELISpot プレートはどちらも同じタイプのPVDF 膜を使用しています。2 つの色をご用意しているのは、リーダーにおけるわずかな違いが見られるためですが、それほど重大なことではありません。マブテック社のELISpot PRO、ELISpot PLUS 商品には原則的に白色プレートが含まれます。
ELISpot プレートの膜は、多孔性で疎水性の構造です。大量のキャプチャー抗体を結合させるためには、膜をエタノール処理し、親水性にする必要があります。高密度での抗体コートを可能にし、高い質のスポットを得るために必要な作業です。エタノール処理は、プレートコーティングガイドに従って行って下さい。
Plate coating guide をご参照下さい。
活性化は、短いエタノール処理により膜を親水性にすることで成し遂げられます。エタノール処理は簡単で、短い作業ですが結果に重大な結果をもたらします。使用するELISpot プレートによって、異なるエタノール処理方法が必要となります。
- エタノールの濃度、量、インキュベーション時間はとても重要なファクターです。
- エタノール処理後、プレートを乾燥させないで下さい。
Plate coating guide をご参照下さい。
プレートは、マルチチャンネルピペットを用いてマニュアルで洗浄することが可能です。洗浄ステップでは、滅菌状態である必要はなく、通常のELISA プレートウォッシャーの洗浄ヘッドをELISpot プレートに適合させることで使用可能です。プレートは、逆さまにして廃液入れの上で軽くはじき、空にします。廃液からプレートに液がはねないように注意して下さい。膜の裏面に液体が付かないようにすることも重要です。トレーに液体が入ってしまった場合は、プレートを戻す前に除いて下さい。プレートが空になったら、プレートをきれいなペーパータオルの上で逆さまにし、軽くはじくことで残った液体をウェルから除去します。基質反応を行った後の最後の洗浄ステップでは、BCIP/NBT-Plus の場合は水道水で、TMB の場合は脱イオン水または蒸留水でリンスします。
プレコート済ELISpot またはFluoroSpot は、ready-to-use で、完全に自動化された方法で、無菌条件下で最適な捕捉抗体濃度がコートされたプレートです。プレコート済プレートは、エタノールによる前処理と抗体のコートが必要ないため便利です。また、手作業でコートする方法で生じる誤差による最終的な誤差を最小限にします。プレコート済プレートは、小さなスケールの実験用に、12 × 8-well のストリップタイプも取り扱っています。
ELISpot プレートは、抗体をコートするのが多孔性の疎水性のPVDF 膜で多量のキャプチャー抗体が結合することができます。これは分泌された局所的に高濃度なタンパク質を高感度で検出するのに適しています。より少ない抗体量をコートした場合、一般的にシグナルは弱くなり、拡散し、大きなサイズのスポットとなり、ELISpot リーダーや手作業でのカウントが難しくなります。最適なELISpot の抗体コート量は、それぞれの系によって若干変わりますが、通常のコート量は1-1.5 μg/well です。一方、ELISA プレートの抗体コート量は、その約10 分の1 量になります。
Plate coating guide をご参照下さい。
滅菌状態で、蒸発を防いだ状態(例:パラフィルムでプレートを巻く) の場合、プレートはコーティング抗体溶液とともに1 週間冷蔵庫で置いておくことが可能です。次の操作に移る前に、プレートを乾燥させないことが重要です。このように保存されたプレートの機能性はご自身で評価して下さい。
ELISpot とFluoroSpot アッセイは、基本的に単一細胞レベルでタンパク質分泌を検出したいと思う、あらゆる細胞に適用することができます。非接着細胞と接着細胞のどちらの細胞も分析することが可能です。しかし、今までのところ、この技術は主に抗原で活性化されたT 細胞から分泌されたサイトカインやB 細胞から分泌された抗体の同定に使用されてきました。抗原特異的なリンパ球のように細胞集団の中で、分泌する細胞が少数である場合、この高感度なアッセイは特に価値のあるものになります。
Cells for ELISpot and FluoroSpot をご参照下さい。
凍結細胞もELISpot/FluoroSpot に適しています。しかしながら、結果は細胞の質に依存するので、高い生存率を得る凍結融解方法を確立しなければなりません。基本的な凍結方法は、DMSO にウシ胎児血清などを加え、段階的に凍結する方法です。
Cells for ELISpot and FluoroSpot をご参照下さい。
1 ウェルに加える細胞の数は細胞のタイプによって、予測される分泌細胞の頻度に合わせて調製することが必要です。頻度が非常に低い場合(例:10,000 細胞に対し1 細胞)、250,000 cells/well 程の多くの数の細胞が必要になります。頻度が高い場合(10 細胞に対し1 細胞)、5,000 cells/well 程の数で十分です。細胞の数は、最適な細胞間接触(例:十分な刺激のための抗原提示細胞との接触)を必要とするため、必ずしも直線的になるとは限りません。抗原特異的T 細胞、PBMC は、200,000 cell/well より少ない数を用いるべきではありません。
マブテック社では、500,000 cell/well 以上の細胞を使用することはお奨めしておりません。細胞による層ができてしまい、細胞とELISpot メンブレンの距離が大きくなることでスポットの質の低下を招く恐れがあります。
ヒト血清をELISpot に使用することはお奨めしておりません。理由は下記の通りです。
- ヒトサンプルを検出する場合、検出したいアナライト(例:IFN- γ, IgG) がその血清に含まれているかもしれません。アナライトがキャプチャー及び検出抗体に結合し、膜が全体的に暗くなる原因となります。
- ヒト血清には異好性抗体が含まれている可能性があり、多くの種のイムノグロブリンに交差します。この活性がアッ セイ抗体を架橋されてしまい、サンドイッチイムノアッセイにおいて問題が生じます。
ALP(アルカリフォスファターゼ) とHRP(ホースラディッシュペルオキシダーゼ) はイムノアッセイに一般に使用される酵素です。それらは異なる反応を触媒するため、別の基質が必要です。ELISpot アッセイにおいて、これらは同程度の感度を示しますが、HRP の方がより速く反応します。
Enzymes & substrates をご参照下さい。
ELISpot では、Western blot に使用されるものと類似した沈降性の基質を必要とします。ELISA の基質はスポットを得ることができませんので、ELISpot には使用できません。マブテック社ではALP に対してはBCIP/NBT-plus を、HRP に対してはTMB の使用をお奨めしています。
Enzymes & substrates をご参照下さい。
最後のプレートの洗浄を水道水で行うことで、まれに青色のTMB スポットが黄色に変わることが見られる場合があります。これは、水中の高いイオン化物によって引き起こされます。もし、水の質に懸念がありましたら、基質反応後、脱イオン水または蒸留水でリンスしていただくことをお奨めします。ALP 酵素+BCIP/NBT-plus 基質は同様の問題は起こりません。
抗原特異的B 細胞ELISpot には2 つの異なる方法があります。一つは、抗原をコートする方法でもう一つは、抗原をビオチン化する検出方法です。抗原をビオチン化することの主な利点は、抗原の量が非常に少なくて済むこと(一般的には約100 倍少ない)です。また、スポットの収量と質がより良く、細胞培養の間に抗原が分解される状態にさらされることはありません。しかしながら、抗原のエピトープが干渉を受けてしまうリスクはどちらの方法でもありますので、新しい抗原を用いる際にはアッセイごとにテストすることが望ましいです。
ELISpot assay principle をご参照下さい。
マブテック社の一般的な推奨は、識別できる個々のスポットが現れるまで置きます。いくつかのアナライトは高い濃度で分泌され、一方で低いレベルで生産されるアナライトもあります。この方法に慣れるまで、双眼実体顕微鏡または拡大鏡を使用して基質反応を確認することが望ましいです。膜の小さなバックグラウンドの染色は問題なく、プレートを乾燥させる過程で消えるでしょう。また、刺激無の細胞のスポットを観察することも望ましいです。顕微鏡でスポットの出現を観察することができます。
Enzymes & substrates をご参照下さい。
非特異的なスポットはまれですが、起こり得ます。原因の一つとして保存したビオチン化抗体が凝集することが挙げられます。もう一つの原因は試薬やバッファーのコンタミネーションや塵の影響が考えらえます。非特異的なバックグラウンドを軽減するには、検出抗体のウォーキング溶液を0.2 μm のフィルターを通していただくことをお奨めしています。
マブテック社Image gallery よりご覧いただけます。または、弊社サポート情報ページからご覧ください。
ELISpot assay principle をご参照下さい。