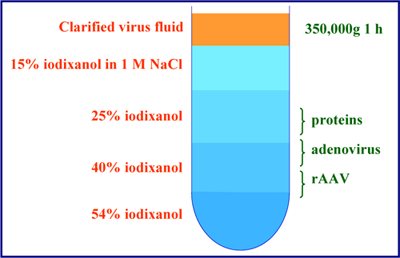
Hermensらの方法2.を適用し、近垂直ローターで予め連続グラジエントを作成します。凍結/解凍により培養細胞からrAAVを放出させた後、ウイルス粒子を硫酸アンモニウム沈殿法またはセルファイン硫酸塩カラムクロマトグラフィーにより濃縮します。
3a. 必要な試薬
A. OptiPrep
B. PBS
3b. 超遠心分離機ローター条件
約5mLチューブを約360,000gで遠心できる近垂直ローター(Section 4のNote 7を参照)
3c. プロトコール
1. 硫酸アンモニウム沈殿法またはクロマトグラフィーにより濃縮した後、rAAVをPBS(pH7.4)に懸濁します。
2. rAAVを含む液体2.7mLを適当なチューブに移し、その下層にOptiPrepをロードしてチューブを満たします。
3. チューブを密封した後、グラジエントマスターで80°、20rpmで12分間回転させてグラジエントを形成させます(Section 4のNote 8を参照)
4. 16℃、71,000rpm(348,000gav)で、3時間遠心します(Section 4のNote 8を参照)。
5. チューブの底から穿刺によりグラジエントを回収します。rAAVのバンドは、グラジエントの底部近くにあります(Section 4のNote 9を参照)。
1. 小さい容量のチューブを使用する場合は、サンプルやロードするグラジエント層の量を、チューブの容量に比例してスケールダウンしてください。ローターの遠心力が350,000gavに達しない場合は、遠心時間を長くする必要がある場合があります。
2. グラジエント層に交互にフェノールレッド(0.01μg/mL)を添加することで、層を視覚識別しやすくなります。350,000gで遠心すると、イオジキサノール自身が沈降し、グラジエントの境界線が不明瞭になることがあります。
3. rAAVがセルライセート中でタンパク質と凝集してしまうと、異質な凝集物が広い範囲の密度を示すため、単離するのに深刻な問題を引き起こします。15%イオジキサノール溶液中に1M NaClを加えることで、この凝集を防き、rAAVを40%イオジキサノール層中でシングルバンドとして単離できます。
4. このグラジエント法では使用する液量が多いため、イオジキサノール溶液をロードするのにぜん動ポンプを用いることで操作が簡単になります。非連続グラジエントの調製方法の詳細については、Application Sheet V02をご参照ください。
5. ライセート中に混入したタンパク質は25%/40%イオジキサノールの境界線に、混入したアデノウイルスの99%以上はrAAVより低い密度(<1.22g/mL)に収束します。
6. イオン交換やヘパリンアフィニティクロマトグラフィなどの追加精製は、イオジキサノールを含むフラクションから直接実施することができます。
7. 参考文献2では、NVT90が使用されています。その他の垂直又は近垂直ローターでも同程度の堆積経路長であれば適用できます。
8. rAAVの密度が高いため、グラジエントの底部の密度は、rAAVがチューブの底に達するのを防ぐのに十分に高い必要があります。グラジエントマスターで形成させたグラジエントは、底部に近づくに連れて密度勾配が鋭く増加する傾向があり、その傾向はその次の遠心でさらに強まります。
9. グラジエントの回収方法の詳細については、Application Sheet V04をご参照ください。
1. Zolotukhin, S., Byrne, B.J., Mason, E., Zolotukhin, I., Potter, M., Chesnut, K., Summerford, C., Samulski, R.J. and Muzyczka, N. (1999) Recombinant adeno-associated virus purification using novel methods improves infectious titer and yield Gene Ther., 6, 973-985
2. Hermens, W.T.J.M.C., Ter Brake, O., Dijkhuizen, P.A., Sonnemans, M.A.F., Grimm, D., Kleinschmidt, J.A. and Verhaagen, J. (1999) Purification of recombinant adeno-associated virus by iodixanol gradient ultracentrifugation allows rapid and reproducible preparation of vector stocks for gene transfer in the nervous Human Gene Ther., 10, 1885-1891
3. Bloom, M.E., Best, S.M., Hayes, S.F., Wells, R.D., Wolfinbarger, J.B., McKenna, R. and Agbandje-McKenna, M. (2001) Identification of Aleutian mink disease parvovirus capsid sequences mediating antibody-dependent enhancement of infection, virus neutralization, and immune complex formation J. Virol., 75, 11116-11127
4. Lock, M., Alvira, M., Vandenberghe, L.H., Samanta, A., Toelen, J., Debyser, Z. and Wilson, J.M. (2010) Rapid, simple, and versatile manufacturing of recombinant adeno-associated viral vectors at scale Hum. Gene Ther., 21, 1259–1271
 多用途密度勾配遠心分離媒体 OptiPrep™ (オプティプレップ)
多用途密度勾配遠心分離媒体 OptiPrep™ (オプティプレップ) グラジェントマスター 短時間に遠心チューブ6本の連続勾配を作製できます
グラジェントマスター 短時間に遠心チューブ6本の連続勾配を作製できます