- 商品情報 B細胞 ELISpot/FluoroSpotキット
- 関連情報 ELISpotキット
- スライド資料 B細胞 [PDF:432KB]
技術情報
背景
抗体の反応性や特異性を利用したアッセイ方法にはELISAやイムノブロット、フローサイトメトリーなどをはじめさまざまなものがありますが、抗体を分泌する細胞(antibody-secreting cell: ASC)に直接焦点をあてたアッセイ方法はほとんどありません。これについて、B-cell ELISpotという手法が1983年にはじめて提唱されました1,2。この方法では、高感度かつ細胞レベルでサンプル中の抗体分泌細胞(ASC)の総数や特定の抗原に対する分泌抗体を同定・数値化することができます。またこの方法では、たとえば血液中に長期間存在する記憶B細胞の存在の頻度を実証するために用いるなど、通常の他の手法では容易に得ることのできなかった情報を得ることができます3。
B-cell ELISpotが特異的抗体応答を検出する方法のなかで最も高感度な手法のひとつとして認識されているにもかかわらず、抗原特異的T-cell応答を解析する標準ツールとして確立されているサイトカインELISpot4と比較するとB-cell ELISpotはあまり広く用いられていません。これには近年ワクチン開発における注目細胞としてT細胞に大きな焦点があてられていることや抗体測定に関する一般的な手法が他にも多数あるなどいくつかの理由があります。しかしながら、B-cell ELISpotに有効な試薬やプロトコールがないことも一因であると考えられます。たとえ自家製の試薬やシステムが効果的に機能するとしても、得られた結果が最適かどうかはしばしば確実ではなく、多くの場合結果の技術的な質はサイトカインELISpotで得られるものと比べると大きく劣っています。
最適で有効な試薬の必要性を満たすために、我々はヒトおよびマウスサンプル中のB細胞が分泌する異なるアイソタイプの抗体を解析するためのELISpotキットを開発しました。我々はまた、従来のアッセイにおけるELISpotプレートへ抗原を固相化する方法の代わりとなる、抗原を検出試薬として用いた改良プロトコールを確立しました。
B-cell ELISpotの2種類の手法
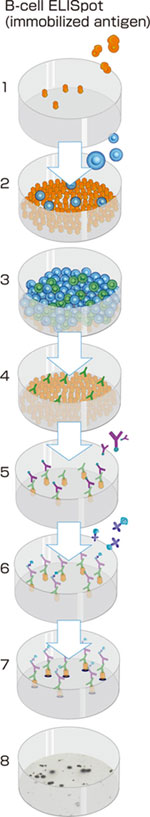
はじめの説明のように、B-cell ELISpotは従来法にごくわずかな改良を加えて行われてきました。図1および3Aに示すように、抗原をまずELISpotプレートのメンブレンに固相化し、ここにB細胞を含む細胞調製物を添加し試験を行います。適切な時間インキュベーションを行い、十分に抗体を分泌させ固相化抗原に結合させ、続いて結合した抗体を検出試薬を加えて検出します。検出試薬には、ビオチン標識抗Ig(イムノグロブリン)抗体および酵素標識アビジンあるいは、ストレプトアビジンを用います。最後に沈降基質を加えて発色させ、スポットを顕微鏡か望ましくはELISpotリーダーを用いて観察・数値化します。
|
|
図1: 1) 2-4) 5) 6-7) 8) |
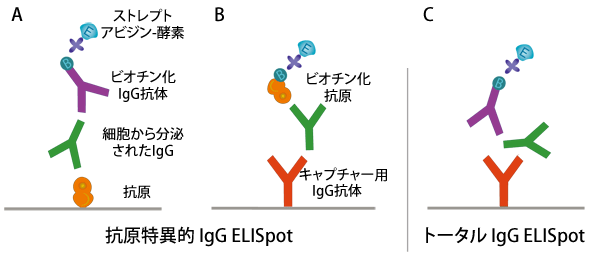
図3:
抗原特異的B-cell ELISpotの2つの手法の図式化
(A)抗原を固相化に使用
(B)抗原をビオチン標識して検出に使用
図の例ではIgG産生細胞に限定した解析を示し、IgG分泌細胞の総数は(C)で示すように定量する。
この手順はシンプルで簡単である一方で、抗原に関していくつかの欠点を持っています。明瞭なスポットを得るためには、抗原を比較的高濃度で固相化する必要がありますが、そうした場合エピトープに抗体が接近しにくくなる可能性が生じます。更に、抗原は血清含有培地と細胞の存在下、37℃でのインキュベーションで分解されないよう耐えなければなりません。実際には、抗原へのアクセスがしばしば制限され、メンブレンに結合して培養環境にさらされた状態での抗原の命運は、コントロールが困難です。この問題により、感度の低下による品質の劣ったスポットを伴う結果がしばしば得られることとなります。
これらの問題を防ぐために、我々は抗原を検出試薬として利用した新規のB-cell ELISpotフォーマットを開発しました。これが第2の手法です。図2および3Bに示すように、このアッセイはELISpotプレートにキャプチャーとして、抗Ig抗体をコートすることから始まります。この抗体には、すべてのイムノグロブリンと結合する抗体あるいは特異的なアイソタイプ(IgGやIgAなど)やサブクラスと結合する抗体を選択できます。細胞と培養している間に、抗体分泌細胞(ASC)から分泌された抗体がそれらの抗原特異性とは無関係にキャプチャー抗Ig抗体に結合します。適切な抗原特異性をもつ抗体を分泌する細胞のみを検出するために、ビオチン標識抗体を加え、続いてストレプトアビジン-酵素を加えてインキュベーションし最後に基質を加えます。我々が実験を行ったいくつもの抗原システムではこのB-cell ELISpotの第2の方法はよりはっきりとした評価しやすいスポットを得、膜上のバックグラウンド染色を低減させ、また多くの場合感度の向上をもたらします(図4、5参照)。これらの利点に加え、抗原必要量は約20-200倍少なくて済み、抗原が細胞培養中に分解してしまう可能性もなくなります。
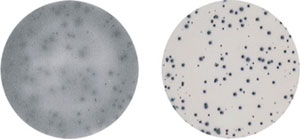 |
図4: 抗ヒトIFN-γ抗体(IgG1)を産生するマウスハイブリドーマ(200 cells/well)をELISpotプレート中にで加え一晩インキュベーションする。 左図: 右図: それぞれのプレートをAID GmbH社製ELISpotリーダーで評価。 |
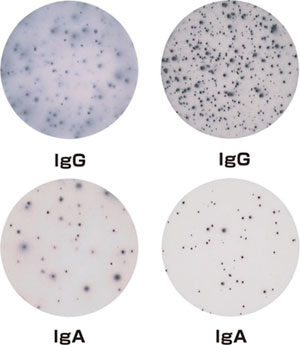 |
図5: オボアルブミンを3回免疫したBalb/cマウスの脾臓細胞(250,000 cells/well)をELISpotプレート中に加え一晩インキュベーションする。 左図: 右図: |
B細胞の由来
ほとんどのB細胞がELISpotアッセイで試験可能である一方、アッセイ条件は細胞の由来や段階によって異なります。たとえば血液やリンパ組織由来のサンプルを用いる場合、細胞は急性感染や免疫/ワクチン投与したばかりの場合には活性化型となっていたり、記憶細胞型となっている可能性があります。活性型細胞が既に抗体を分泌する状態(リンパ球芽様あるいは形質細胞)となっているのに対し、記憶B細胞は抗体を分泌し始めるまでにアクチベーターであるポリクローナル抗体で数日間刺激する必要があります。通常用いる条件では、このような刺激を受けていないB細胞はアッセイでは検出されません。
細胞がin vivoで活性化されている場合は、細胞をプレートに加え、更なる刺激は与えずに細胞培養培地中でインキュベーションします。しかしながら、たとえばワクチン接種後の血中の抗体分泌細胞(ASC)を検出できる期間は驚くほど短期であるということがこれまでの研究でわかっています。実際、細胞は抗原投与後5-10日のものを集める必要があります。その期間を過ぎると抗体分泌細胞の循環数は急激に減少してしまいます。
一方記憶B細胞の場合は、予め刺激を与えることで検出可能量の抗体を産生させておく必要があります。通常の操作では、B細胞の増殖や変異を調節する因子の存在下で細胞を培養するプレインキュベーションステップでこれが行われます。必要な因子についての十分で正確な知見がないため刺激方法について多くのプロトコールが存在し、なかには、異なる細胞増殖シグナルの組み合わせによる刺激方法(たとえばヤマゴボウマイトジェン、CpG、黄色ブドウ球菌など)もあったりします。刺激を与える期間はさまざまですが、通常は3-8日間です。低頻度応答の検出を促進するために、B細胞数を増やす目的でインキュベーション時間を長くとることがあります。その場合は、プレインキュベーション後、ELISpotプレートに加える前に、細胞を洗浄して培養液中に存在する抗体を除去します。
in vitroでの細胞の増殖によりサンプル中のB細胞の均衡が崩れるため抗原特異的なスポット数は通常存在する抗体分泌細胞の総数との比較で表されます。抗体分泌細胞の総数はビオチン標識抗原の代わりにビオチン標識Ig抗体を用いて定量されます(図2、3C参照)。
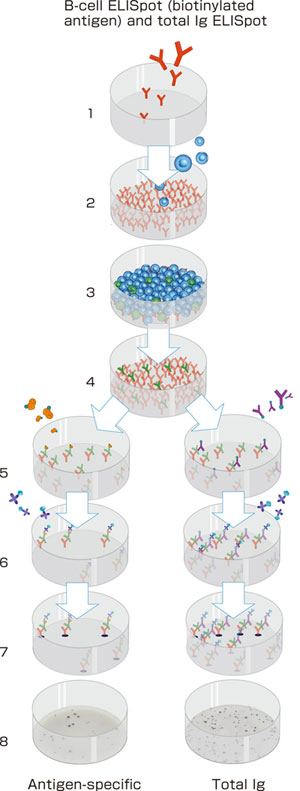 |
図2: 1) 2-4) 5) 6-7) 8) |

図3:
抗原特異的B-cell ELISpotの2つの手法の図式化
(A)抗原を固相化に使用
(B)抗原をビオチン標識して検出に使用
図の例ではIgG産生細胞に限定した解析を示し、IgG分泌細胞の総数は(C)で示すように定量する。
ヒト由来の細胞サンプルは通常末梢血単核球(PBMC)の形態ですがリンパ組織あるいは粘膜部位から得られたサンプルの場合もあります。B細胞は一般的に細胞のマイナー画分に存在しますので、(PBMCの5-12%)、たとえば抗CD19抗体磁気ビーズを用いたポジティブセレクションあるいは非B細胞除去などによる濃縮が必要な場合があります。濃縮操作によりそれぞれのウェル中のB細胞数が増えるため、感度が向上します。
マウスのB細胞は脾臓あるいは他のリンパ組織から得られたものが、一般的に用いられますが、末梢血由来のサンプルも用いられることがあります。しかし脾臓細胞からは十分量のB細胞が得られるのに対し、末梢血の場合は解析に十分な量の細胞を得ることは難しい場合があります。
 |
図4: 抗ヒトIFN-γ抗体(IgG1)を産生するマウスハイブリドーマ(200 cells/well)をELISpotプレート中にで加え一晩インキュベーションする。 左図: 右図: それぞれのプレートをAID GmbH社製ELISpotリーダーで評価。 |
 |
図5: オボアルブミンを3回免疫したBalb/cマウスの脾臓細胞(250,000 cells/well)をELISpotプレート中に加え一晩インキュベーションする。 左図: 右図: |
方法論的側面
これまでに成功しているサイトカインELISpotのほとんどの方法論的側面は、B-cell ELISpotにも適用することができます。エタノールで前処理し、比較的高濃度の抗体あるいは抗原でコートしたPVDFメンブレンプレートを用います。これらの方法ではスポットカウントや評価を手助けするだけでなくアッセイの感度を増加させ高い強度の明瞭なスポットを得ることができます。
免疫学的アッセイのすべてにおいて、試薬は高品質で最適な性能を確認したものでなければなりません。たとえば、抗IgG抗体はすべてのIgGサブクラスに同等の反応性を示し、アイソタイプ特異的試薬は特定のアイソタイプにのみ反応するものでなければなりません(図6参照)。またキャプチャー抗体や検出試薬だけではなく、細胞培養に用いる培地や血清も高品質のものが必要です。これを保証するために、複数の血清ロットを前もって評価しなければなりません。また、牛胎児血清が一般的にアッセイに用いられますが、自己血清には抗体が含まれアッセイに干渉しますので避ける必要があります。
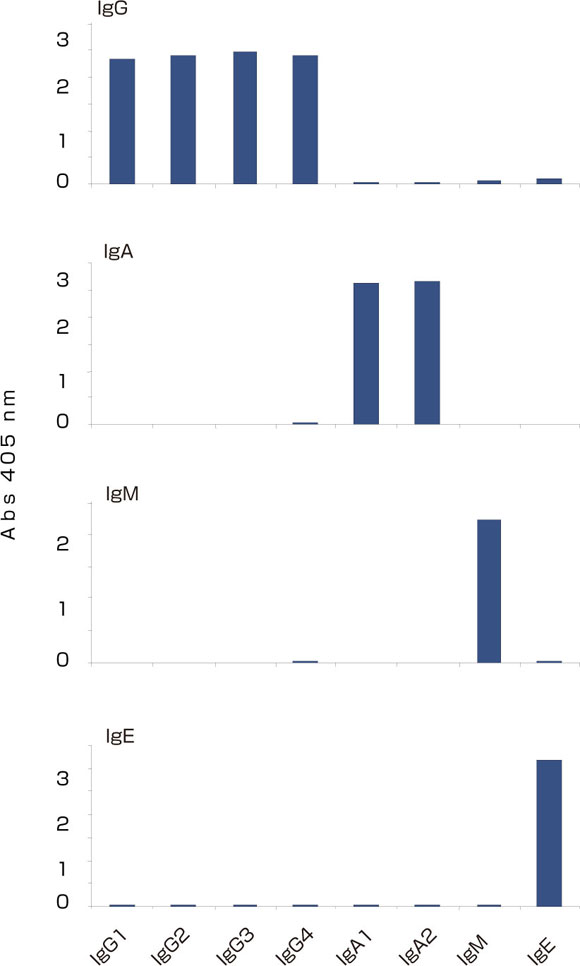 |
図6: マブテック社B-cell ELISpotシステムを用いた、ヒトIgG、IgA、IgM、IgEに対する特異性解析 IgG、IgA、IgMをキャプチャーに用い、ELISA法にてそれぞれIgアイソタイプ/サブクラス 10ng/mlで反応性を解析した。IgEについては50ng/ml濃度で解析した。 |
前述したように、ウェルに加える細胞数は陽性細胞の頻度に強く影響します。しかしながら、抗原特異的細胞が非常に低頻度にしか存在しないと想定されるケースであっても、5x105 cells/well以上の細胞をウェルに加えると細胞が多重層を形成し、上部層の細胞が弱いシグナルやはっきりしないスポットを産生してしまう傾向があるため、このような状況は避けなければなりません。
B-cell ELISpot は抗体の免疫応答のさまざまな面を解析するための強力なツールです。またB-cell ELISpotは高感度のアッセイが要求される状況や細胞レベルでの応答研究にとって特に適しています。
B-cell応答の検出には自然感染およびワクチンによる誘発感染の2つの主要なアプリケーション分野があります6-8。ワクチン誘発型応答の典型例は図7に示すとおりで、経口投与されたコレラトキシンBワクチンに対する抗原特異的IgA分泌細胞数をワクチン投与前後で評価しています。
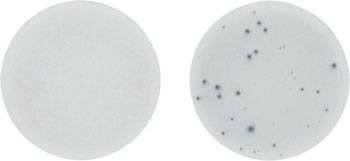
図7:
B-cell ELISpotによるコレラトキシンBに対するヒトIgA応答の解析
コレラトキシンのワクチン「DUKORAL?」を経口投与により投与する前(左)および2回目の投与から7日後の末梢血単核球(PBMC)を回収した。細胞(250,000 cells/well)を抗ヒトIgAを固相化したELISpotプレート中で一晩インキュベーションした。ワクチン特異的な抗体分泌細胞をビオチン標識コレラトキシンBで検出した。
ELISpotは粘膜層や滑液のような内部免疫細胞やさまざまなリンパ組織と同様に、末梢血中のB細胞の解析にも用いることができます。たとえば、ワクチン投与後のリンパ組織中の抗原特異的B細胞の分布の定量に用いたり長期間生存した記憶B細胞の脾臓への一次的な移行を論証するために用いられたりします9,10。
最後に、我々はB-cell ELISpotがそのさまざまな有益な特性により、現在よりもさらに多くの場面に適用可能な優れたアッセイとなることを確信しています。B細胞が防御的役割(感染や癌など)や疾患との関連(自己免疫やアレルギー)等特定の場面における研究と同様に、一般的なB-cell免疫についての更なる知見を得るための研究もその一端です。
■参考文献
- Czerkinsky C, et al. Solid phase enzymelinked immunospot (ELISPOT) assay for enumeration of specific antibody-secreting cells.J.Immunol.Methods 65: 109,1983.
- Sedwick JD and Holt PG. A solid-phase immunoenzymatic technique for the enumeration of specific antibody-secreting cells. Immunol Methods 57: 301, 1983.
- Crotty S, et al.Cutting edge: long-term B cell memory in humans after smallpox vaccination. J.Immunol. 171: 4969, 2003.
- Czerkinsy C, et al. Reverse ELISpot assay for clonal analyses of cytokine production. J.Immunol. Methods 110 : 29, 1988.
- Vallerskog T, et al. Serial re-challenge with influenza vaccine as a tool to study individual immune responses. J. Immunol. Methods 339: 165, 2008.
- Doria-Rose NA, et al. Frequency and phenotype of human immunodeficiency virus envelope-specific B cells from patients with broadly cross-neutralizing antibodies. J. Virol. 83: 188, 2009.
- Malaspina A, et al. Compromised B cell responses to influenza vaccination in HIV-infected individuals. J. Infect. Dis. 191 : 1442. 2005.
- Kelly DF, et al. CRM197-conjugated serogroup C meningoccal capsular polysac caride, but not the native polysaccharide, induces persistent antigen-specific memory B cells. Blood 108: 2642, 2006.
- Banasconi NL, et al. Maintenance of serological memory by polyclonal activation of human memory B cells. Science 298: 2199, 2002.
- Mamani-Matsuda M, et al. The human spleen in a major reservoir for long-lived vaccina virus-specific memory B cells. Blood 111: 4653, 2008.
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては
使用しないように、十分ご注意ください。