- 商品詳細:PureExo® エクソソーム単離キット
技術情報
推奨前処理方法
- 血清
チューブに全血採血後、室温で放置して血液を凝固させます(通常15〜30分かかります)。冷却遠心分離機で1,000〜2,000×g、10分間遠心分離し、血液凝固塊を除去し血清を得ます。血清は2〜8℃で保存してください。血清を直ちに分析しない場合は、0.5mLに分注し、-80℃以下で保存、輸送してください。凍結融解は多くの血清成分にとって有害であるため、なるべく避けてください。 - 血漿
EDTA処理チューブに全血を採取します。ヘパリン処理チューブはエクソソームRNA活性を低下させるので、絶対に使用しないでください。冷却遠心機を用いて1,000〜2,000×gで10分間遠心することにより血漿から細胞を除去します。2,000×gで15分間遠心すると、サンプル中の血小板が除去され血漿が得られます。サンプルは、作業中は2〜8℃に保ち、直ちに分析しない場合は、0.5mLに分注し、-80℃以下で保存、輸送してください。凍結融解はなるべく避けてください。
プロトコル
※プロトコルは定期的に更新される可能性があるため、本情報は最新版ではない可能性がございます。 必ず製品付属のプロトコルをご確認ください。
キット構成品
| 構成品 | 容量 | ||
|---|---|---|---|
| 品番: P101 | 品番: P101L | 品番: P101S | |
| Solution A | 3mL |
12mL |
0.6ml |
| Solution B | 3mL |
12mL |
0.6ml |
| Solution C(キットに含まれません) | 3mL |
12mL |
0.6ml |
| Sample Buffer | 20mL |
80mL |
4mL |
| PureExo® Column | 10 |
40 |
2 |
重要ポイント:各反応で500µLを超える血清または血漿を処理しないでください。不明瞭な層の分離やカラムの目詰まりの原因となります。
Solution Cのクロロホルムはキットに含まれていません。
- 100〜500µLの血清または血漿サンプルを収集し、氷上に保管します。 凍結サンプルから始める場合は、サンプルを室温で完全に解凍してから、氷上に保管してください。 (血清/血漿の収集および調製手順については、推奨前処理方法を参照してください)。
- 血清/血漿サンプルを3,000×g、4℃で15分間遠心分離し、破片を除去します。
重要ポイント:この手順をスキップすると、手順17でフィルターが目詰まりする可能性があります。
オプション:高脂質含有量の血清/血漿サンプル(高脂血症患者の血清サンプルなど)を処理する場合は、ペレットを乱さずに上清を新しい遠心チューブに移します。 上清を4℃で2時間インキュベートし、次に1,000x g、4℃で10分間遠心分離し、脂肪の沈殿を取り除きます。 - ペレットを乱すことなく、100〜500µLの透明な上清を15mLの遠心チューブに移します。 上清にサンプルバッファーを加えて、希釈した血清/血漿サンプルの総量を2 mLにし、氷上に静置します。 この希釈は、開始容量100〜500µLでうまく機能します。 1回の反応で500µLを超えるサンプルを処理しないでください。
- 1.5mLのマイクロ遠心チューブに、溶液A、B、Cを次の順序で加えて0.9mLの混合物A / B / Cを調製します(常にこの混合物A / B / Cを使用直前に調製します。混合物A / B / Cは保存できません。)
1回目の添加溶液A:0.3 mL
2回目の添加溶液B:0.3 mL
3回目の添加溶液C:0.3 mL
※蒸発を防ぐため、使用後はすぐにボトルにキャップをしてください。 - 混合物A/B/Cを10秒間ボルテックスし、均一にします。
- 0.9mLの混合物A / B / Cを2mlの希釈血清/血漿サンプルに加えます(ステップ3のサンプル)。
- 15mLチューブに蓋をし、チューブを少なくとも10回静かに反転させてよく混合し、4℃で30分間インキュベートします。
- チューブを5,000×gで3分間遠心させます。
- A . 混合物が以下の3つの異なる層に見えるようになります。

middle fluffy layerを乱さないで、ステップ10に進みます(3つの異なる層がない場合にのみステップ9Bを参照してください)。
B. 一部のサンプルでは、層の分離が明確ではありません。 下の図に示すように、3つの層が不正確に表示されます。Top cloudy layer(水層)、middle whiteccloudy layer(上部層よりも厚く、透明度が低い)、bottom colorless layerです。

最上層を注意深く取り除き、廃棄します。middle whiteccloudy layerを乱したり、取り除いたりしないように注意してください。(エクソソームがこの層に存在するため)
ステップ4と5の説明に従って、さらに0.9mLの混合物A / B / Cを準備し、middle white cloudy layerとbottom colorless layerを含むチューブに追加します。 チューブを少なくとも10回静かに反転させて、よく混合します。 4℃でさらに30分間インキュベートします。 その後、チューブを5,000×gで3分間遠心させます。 これで、ステップ9Aに示すように、混合物は3層として表示されます。 次に、ステップ10に進みます。 - top transparent layerをピペットで取り出し、middle whiteccloudy layerを乱さずに廃棄します。middle whiteccloudy layer(エクソソームはこの層に存在)を新しい1.5mlマイクロ遠心チューブに移します。 5,000×gで3分間遠心する。 遠心後、新しく3層に分離:top transparent layer、middle whiteccloudy layer、bottom colorless layer(下図を参照)。
重要ポイント:すぐに次のステップに進んでください。

- top transparent layerをピペットで取り出し、廃棄します。 ピペットチップをチューブの底まで挿入して、底の無色の層を完全に取り除き、廃棄します。 チューブにはmiddle whiteccloudy layerのみを入れてください。 (エクソソームはこの層にあります。)
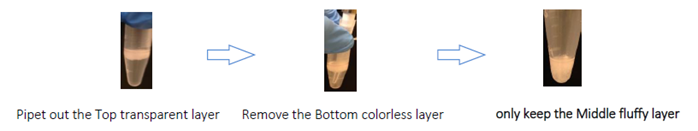
- 5,000x gで3分間再度遠心すると、3つの層が再び現れます。 ここで、ステップ11をもう一度繰り返します。 これで、「fluff pellet」だけがチューブに残ります。 この実験例では、「fluff pellet」の容量は約25µLです。
- チューブキャップを開いたまま、室温で5〜10分間風乾します(過度に乾燥させないでください)。
- 収集したfluff pelletの4倍量の1×PBSをチューブに加えます。 この実験例では、100µLのPBS(4x25µLのfluff pellet)を追加しました。fluff pelletを40回激しく上下にピペッティングして再懸濁します。
- チューブを水平シェーカーで3分間高速で振盪後、激しくピペッティングする操作を10回繰り返します。これをさらに2回繰り返します。
重要ポイント:fluff pelletが十分に再懸濁されていない場合、エクソソームがfluff pellet中に閉じ込められ、エクソソームの純度と収量が低下する可能性があります。例えば。 高脂血症患者のサンプルでは、fluff pelletを解離してエクソソームを放出することは困難です。 このような場合は、このステップでピペッティングと振盪時間を延長してください。 - チューブを5,000xgで5分間遠心します。 「fluff pellet」を乱さずに、上清を1つのPureExo®カラム(付属)に慎重に移します。
重要ポイント:「fluff pellet」は4℃に保ってください。 実験が終了するまで廃棄しないでください。 - PureExo®カラムを3,000×gで5分間遠心して、分離された純粋なエクソソーム(PBSに懸濁されたエクソソーム)である「flow-through」を回収します。
分離されたエクソソームは、下流のアッセイに直接使用することも可能です(例:101Bio Exosomal RNA and Protein Extraction Kit, 品番: P200を使用してエクソソームRNA/Proteinを抽出)。また、4℃で1週間、または-80℃で3ヶ月間保存することも可能です。濃縮したエクソソームは、放置すると沈殿します。ご使用の際には、ピペッティングを行い、再度よく懸濁してください。
トラブルシューティング
- 最終的なエクソソームの収率が低い場合。
- カラムに液体が残っていないか確認してください。残っている場合は、汚染されたタンパク質によってカラムが目詰まりしていることを示しています。目詰まりの原因としては、ステップ2でデブリが完全に除去されていない、サンプル中の脂質タンパク質が多すぎる(例:高脂血症)、ステップ16で沈殿物をピペッティングした、サンプルの投入量が多すぎる、などが考えられます。目詰まりが発生した場合は、再度サンプルを準備し、サンプルの量を減らし、ステップ2と16にご注意ください。
- サンプルの種類によっては、fluff(ステップ15)に粘着性があり、fluffからエクソソームを放出することが困難な場合があります。(エクソソームの一部がfluffに捕捉されている可能性があります。)最終のflow-throughを4℃で保存したfluffペレットに戻し(ステップ16から、エキソソームはこのfluffペレットにトラップされています)、EDTAを最終濃度3mMになるように加えます。
例えば、0.5M EDTAストック溶液(500mM EDTA)を使用する場合、100µLのflow-throughに0.6µLのEDTA原液を加える必要があります。計算方法は以下の通りです。
EDTAストック液容量=(最終総容量×最終濃度)/EDTAストック液濃度
= (100 µL x 3 mM) / 500 mM
= 0.6µL
勢いよく60回ピペッティングし、チューブを水平シェーカーで20分間振盪します。振盪中に、上下に激しくピペッティングすることを数回繰り返します。別のPureExo®カラムを通過させてエクソソームを回収します。 - サンプルタイプによっては、エクソソームの含有量が少ない場合があります(ステップ9Aで中央のfluff層が薄くなっています)。より多くのエクソソームを回収するために、初期投入サンプル量を増やしてください。
- Flow-throughに複数の層がある場合。
ステップ11-12の間、fluffにbottom layerが残っていた場合、チューブを5,000×gで3分間遠心し、底層を注意深くピペッティングして捨てます。新しいカラムにサンプルを通し、流れてきたものを回収します。 - エクソソームの収率は良好だが、エクソソームのタンパク質レベルが低くなっている場合。 エクソソームの膜は、細胞よりも溶解しにくい為、RIPAバッファーなどの通常の細胞用溶解バッファーでは、エクソソームを完全に溶解してエクソソームタンパク質を抽出するには不十分です。エクソソームのタンパク質を抽出するには、Exosomal RNA and Protein Extraction Kit (品番:P200)の使用をお勧めします。
- エクソソームの収量は良好だが、エクソソームRNAレベルが低い場合。
●RNAの分解が起こっている場合があります。RNase freeの作業環境をご確認ください。
●エクソソームRNAの抽出には、品番:P200キットの使用をお勧めします。 - Exosomal RNAの収量は良好だが、RT-PCRによる増幅が得られない場合。
●内部コントロールの増幅を確認してください。
●プライマーの感度を確認してください。
推奨前処理方法(2mlの細胞培養上清を使用する場合)
- ウシ胎児血清(FBS)は、いわゆる「エクソソームフリーFBS」であっても、エクソソームを含んでいる可能性があるため、無血清培地を使用し培地採取前に48時間細胞を飢餓状態にしてください。
- 培養細胞が腫瘍細胞など増殖性の高い細胞である場合は、まず細胞培養培地を1:2に希釈してください。
- 培養培地がバイオリアクターシステムからのものである場合、培地を2 x 105 cells / 2 ml以下に希釈してください。
プロトコル(2mlの細胞培養上清を使用する場合)
※プロトコルは定期的に更新される可能性があるため、本情報は最新版ではない可能性がございます。 必ず製品付属のプロトコルをご確認ください。
キット構成品
| 構成品 | 容量 | ||
|---|---|---|---|
| 品番: P100 | 品番: P100L | 品番: P100S | |
| Solution A | 2.5mL |
10mL |
0.5ml |
| Solution B | 2.5mL |
10mL |
0.5ml |
| Solution C(キットに含まれません) | 10mL |
10mL×4 |
2.0ml |
| PureExo® Column | 10 |
40 |
2 |
Solution Cのクロロホルムはキットに含まれていません。
- 2mlの細胞培養上清を採取してください。
- 血清/血漿サンプルを3,000×g、4℃で15分間遠心分離し、デブリ(破片)を除去します。
重要ポイント:この手順をスキップすると、手順15でフィルターが目詰まりする可能性があります。 - 透明な上清2mlを新しい遠心チューブに移し、氷上で保存してください。
- 遠心チューブに、溶液A、B、Cを次の順序で加えて0.75mLの混合物A / B / Cを調製します(常にこの混合物A / B / Cを使用直前に調製してください。混合物A / B / Cは保存できません。)
1回目の添加溶液A:0.125 mL
2回目の添加溶液B:0.125 mL
3回目の添加溶液C:0.5 mL
※蒸発を防ぐため、使用後はすぐにボトルにキャップをしてください。
異なる容量の細胞培地を使用する場合、溶液 A/B/C の量は下記の「反応容量表」を参照してください。
※各精製の最大培地量は、細胞数5 x 105 cells、サンプル量4 mlです。本カラムは繰り返し利用できません。推奨サンプル量または細胞数を超えないようにしてください。層分離が不明瞭になり、カラムが詰まることがあります。反応溶量表 Cell culture media
(clear supernatant)Mixture A/B/C = Solution A + Solution B + Solution C 2 ml (minimum) 0.750 ml =0.125 ml + 0.125 ml + 0.50 ml 3 ml 1.125 ml = 0.187 ml + 0.187 ml + 0.75 ml 4 ml (maximum) 1.500 ml = 0.250 ml + 0.250 ml + 1.00 ml - 0.75 mlの混合物A/B/Cを10秒間ボルテックスし、均一にします。
- 0.75 mlの混合物A/B/Cを2mlの培養上清サンプルに加えます(ステップ3のサンプル)。
- チューブに蓋をし、チューブを少なくとも10回静かに反転させてよく混合し、4℃で30分間インキュベートします。
- a. 混合物が以下の3つの異なる層に見えるようになります。

Middle fluffy layerを邪魔しないように、最上層を注意深く取り出して捨てます。次にステップ9に進みます。
b.2層に分離した場合:下図のようにMedium color layerとCloudy layerのように分離します。Medium color layerを慎重に取り除き廃棄し、ステップ9に進んでください。

分離がはっきりしない場合は、さらに0.75mlの混合液A/B/C(この実験例では0.75ml)を加え、チューブを少なくとも10回静かに反転させてよく混合し、4℃でさらに30分間インキュベートします。その後、ステップ8aからやり直してください。 - 新しい遠心管に移し、5,000×g で 3 分間遠心します。下図の通り新たに3層に分離します。すぐに次のステップに進んでください

- 上層のメディウム層をピペットで抜き取り捨ててください。ピペットチップをチューブの底まで差し込み、最下部の無色層を完全に取り除き、Middle fluffy layerのみをチューブに残してください。

- fluffy layer全体を新しい0.5ml遠心チューブに移し、5,000×gで3分間遠心し、ステップ10を再度行います。これで、「fluff pellet」だけがチューブに残ります。 この実験例では、「fluff pellet」の容量は約25µLです。
- チューブキャップを開いたまま、室温で5〜10分間風乾します(過度に乾燥させないでください)。
- 収集したfluff pelletの4倍量の1×PBSをチューブに加えます。 この実験例では、100µLのPBS(4x25µLのfluff pellet)を追加しました。fluff pelletを40回激しく上下にピペッティングして再懸濁します。
- チューブを水平シェーカーで3分間高速で振盪後、激しくピペッティングする操作を10回繰り返します。これをさらに2回繰り返します。 重要ポイント:fluff pelletが十分に再懸濁されていない場合、エクソソームがfluff pellet中に閉じ込められ、エクソソームの純度と収量が低下する可能性があります。例えば。 高脂血症患者のサンプルでは、fluff pelletを解離してエクソソームを放出することは困難です。 このような場合は、このステップでピペッティングと振盪時間を延長してください。
- チューブを5,000xgで5分間遠心します。 「fluff pellet」を乱さずに、上清を1つのPureExo®カラム(付属)に慎重に移します。 重要ポイント:「fluff pellet」は4℃に保ってください。 実験が終了するまで廃棄しないでください。
- PureExo®カラムを1,000×gで5分間遠心して、分離された純粋なエクソソーム(PBSに懸濁されたエクソソーム)である「flow-through」を回収します。
分離されたエクソソームは、下流のアッセイに直接使用することも可能です(例:101Bio Exosomal RNA and Protein Extraction Kit, 品番: P200を使用してエクソソームRNA/Proteinを抽出)。また、4℃で1週間、または-80℃で3ヶ月間保存することも可能です。濃縮したエクソソームは、放置すると沈殿します。ご使用の際には、ピペッティングを行い、再度よく懸濁してください。
分離されたエクソソームは、下流のアッセイに直接使用することも可能です(例:101Bio Exosomal RNA and Protein Extraction Kit, 品番: P200を使用してエクソソームRNA/Proteinを抽出)。また、4℃で1週間、または-80℃で3ヶ月間保存することも可能です。濃縮したエクソソームは、放置すると沈殿します。ご使用の際には、ピペッティングを行い、再度よく懸濁してください。
トラブルシューティング
- 最終的なエクソソームの収率が低い場合。
- カラムに液体が残っていないか確認してください。残っている場合は、汚染されたタンパク質によってカラムが目詰まりしていることを示しています。目詰まりの原因としては、ステップ2でデブリが完全に除去されていない、培養上清に血清が含まれている、ステップ15で沈殿物をピペッティングした、サンプルの投入量が多すぎる、などが考えられます。目詰まりが発生した場合は、再度サンプルを準備し、サンプルの量を減らし、ステップ2と15にご注意ください。
- サンプルの種類によっては、fluff(ステップ15)に粘着性があり、fluffからエクソソームを放出することが困難な場合があります。 (エクソソームの一部がfluffに捕捉されている可能性があります。) この場合、ステップ14のペレットと最終的なエクソソームのflow-through中のエクソソームマーカーレベルをELISAで調べていただくことを推奨いたします。ステップ14のペレットからのシグナルが高い場合、エクソソーム放出ステップは不完全です。 最終flow-throughを、4℃で保存したfluff pelletに戻し(ステップ14)、ピペッティングを上下に60回激しく行い、水平シェーカーで20分間チューブを振ってください。途中で数回、上下に激しくピペッティングを繰り返してください。その後別のカラムに通してエクソソームを回収してください。
- 細胞の種類によっては、エクソソームの産生が少ないものもございます。一般に、細胞は増殖が速い時期にエクソソームを多く産生するといわれています。細胞培養条件(播種密度、分割間隔など)を調整し、より多くのエクソソームを回収するために最適な細胞増殖条件を検討してください。また、より多くのエクソソームを回収するために、初期投入サンプル量を増やしてください。
- Flow-throughに複数の層がある場合。
ステップ11-12の間、fluffにbottom layerが残っていた場合、チューブを5,000×gで3分間遠心し、底層を注意深くピペッティングして捨てます。新しいカラムにサンプルを通し、流れてきたものを回収します。 - エクソソームの収率は良好だが、エクソソームのタンパク質レベルが低くなっている場合。
エクソソームの膜は、細胞よりも溶解しにくい為、RIPAバッファーなどの通常の細胞用溶解バッファーでは、エクソソームを完全に溶解してエクソソームタンパク質を抽出するには不十分です。エクソソームのタンパク質を抽出するには、Exosomal RNA and Protein Extraction Kit (品番:P200)の使用をお勧めします。 - エクソソームの収量は良好だが、エクソソームRNAレベルが低い場合。
●RNAの分解が起こっている場合があります。RNase freeの作業環境をご確認ください。
●エクソソームRNAの抽出には、品番:P200キットの使用をお勧めします。 - Exosomal RNAの収量は良好だが、RT-PCRによる増幅が得られない場合。
●内部コントロールの増幅を確認してください。
●プライマーの感度を確認してください。
推奨前処理方法
- ウシ胎児血清(FBS)は、エクソソームを多量に含んでいるため、無血清培地を使用し培地採取前に48時間細胞を飢餓状態にしてください。
プロトコル
※プロトコルは定期的に更新される可能性があるため、本情報は最新版ではない可能性がございます。 必ず製品付属のプロトコルをご確認ください。
キット構成品
| 構成品 | 容量 | |
|---|---|---|
| 品番: P107 | 品番: P107S | |
| Solution A | 7.5mL |
1.5mL |
| Solution B | 7.5mL |
1.5mL |
| Solution C | 10mL×3bottles |
6.0mL |
| PureExo® Column | 10 |
2 |
- 20mlの細胞培養上清を採取してください。
- 細胞培養上清を3,000×g、4℃で15分間遠心分離し、デブリ(破片)を除去します。
重要ポイント:この手順をスキップすると、手順14でフィルターが目詰まりする可能性があります。 - 透明な上清20mlを新しい遠心チューブに移し、氷上で保存してください。
※各反応の最大培地量は、細胞数1 x 107 cells、サンプル量20 mLです。分離層が不明瞭になり、カラムが詰まることがあるため推奨サンプル量や細胞数を超えないようにしてください。本商品は繰り返し利用できません。 - 遠心チューブに、溶液A、B、Cを次の順序で加えて混合物A / B / Cを調製します(常にこの混合物A / B / Cを使用直前に調製してください。混合物A / B / Cは保存できません。)
1回目の添加溶液A:0.75 mL
2回目の添加溶液B:0.75 mL
3回目の添加溶液C:3.0 mL
※蒸発を防ぐため、使用後はすぐにボトルにキャップをしてください。 - 4.5 mlの混合物A/B/Cを5〜10秒間ボルテックスし、均一にします。
- 4.5 mlの混合物A/B/Cを20mlの培養上清サンプルに加えます(ステップ3のサンプル)。
- チューブに蓋をし、チューブを少なくとも10回静かに反転させてよく混合し、4℃で30分間インキュベートします。
- a. 混合物が以下の3つの異なる層に見えるようになります。

Middle fluffy layerを邪魔しないように、最上層を注意深く取り出して捨てます。次にステップ9に進みます。
b.2層に分離した場合:Medium color layerとCloudy layerのように分離します。Medium color layerを慎重に取り除き廃棄し、ステップ9に進んでください。
分離がはっきりしない場合は、さらに4.5mlの混合液A/B/Cを加え、チューブを少なくとも10回静かに反転させてよく混合し、4℃でさらに30分間インキュベートします。その後、ステップ8aからやり直してください。 - 新しい遠心管に移し、5,000×g で 3 分間遠心します。下図の通り新たに3層に分離します。すぐに次のステップに進んでください

- 上層のメディウム層をピペットで抜き取り捨ててください。ピペットチップをチューブの底まで差し込み、最下部の無色層を完全に取り除き、Middle fluffy layerのみをチューブに残してください。

- fluffy layer全体を新しい1.5ml遠心チューブに移し、5,000×gで3分間遠心し、ステップ10を再度行います。
- チューブキャップを開いたまま、室温で5〜10分間風乾します(過度に乾燥させないでください)。
- 収集したfluff pelletの1~2倍量の1×PBSをチューブに加えます。 この実験例では、200µLのPBSを追加しました。fluff pelletを40回激しく上下にピペッティングして再懸濁します。チューブを水平シェーカーで3分間高速で振盪後、激しくピペッティングする操作を10回繰り返します。これをさらに2回繰り返します。
重要ポイント:fluff pelletが十分に再懸濁されていない場合、エクソソームがfluff pellet中に閉じ込められ、エクソソームの純度と収量が低下する可能性があります。サンプルの種類によっては、ペレットが粘着性で解離しにくく、そこからエクソソームが放出されにくい場合もございます。必要に応じてピペッティングと振とうの時間を延長してください。エクソソームがfluff pelletに捕捉されているかどうかを調べるために、ステップ14のペレットと最終的なエクソソームのflow-through中のエクソソームマーカーレベルをELISAで調べていただくことを推奨いたします。ステップ14のペレットからのシグナルが高い場合、エクソソーム放出ステップは不完全です。 - PureExo®カラムを1,000×gで5分間遠心して、分離された純粋なエクソソーム(PBSに懸濁されたエクソソーム)である「flow-through」を回収します。
- チューブを5,000xgで5分間遠心します。 「fluff pellet」を乱さずに、上清を1つのPureExo®カラム(付属)に慎重に移します。 重要ポイント:「fluff pellet」は4℃に保ってください。 実験が終了するまで廃棄しないでください。
- 分離されたエクソソームは、下流のアッセイに直接使用することも可能です(例:101Bio Exosomal RNA and Protein Extraction Kit, 品番: P200を使用してエクソソームRNA/Proteinを抽出)。また、4℃で1週間、または-80℃で3ヶ月間保存することも可能です。濃縮したエクソソームは、放置すると沈殿します。ご使用の際には、ピペッティングを行い、再度よく懸濁してください。
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては
使用しないように、十分ご注意ください。