- 商品情報:PathPlex® Panel
技術情報
チラミドシグナル増幅(Tyramide Signal Amplification:TSA)ベースの免疫蛍光マルチプレックスアッセイ
マルチプレックス免疫組織染色は、同一組織切片上の複数の抗原を検出できる手法です。タンパク質の共局在や空間的配置が提示でき、標的の細胞内局在化の測定、複数の細胞型の同定、およびバイオマーカーの相対的な近接性の解析を容易にします。具体的には、マルチプレックス免疫蛍光(Immunofluorescent Multiplex:mIF)アッセイではバイオマーカーの発現レベルに関する情報を提供し、また単一スライド上で同時に可視化するバイオマーカー数を増やすこともできます。つまり、サンプルを節約しつつ組織の微小環境に関してより良い情報を得られることなどが、mIFアッセイの利点となります。
mIFにおいてTSA® システムを利用することで、従来法より優れた利点があります。
(例:同一生物種由来の抗体を使用可能、発現量の低いタンパク質を検出可能)
チラミドシグナル増幅では、西洋ワサビペルオキシダーゼ(HRP)標識二次抗体を用いて蛍光色素を組織に共有結合させます。大量の蛍光色素で標識されたチラミドが標的タンパク質に沈着した結果、シグナルが増幅されます。この高い蛍光色素密度により強力なシグナルが得られます。
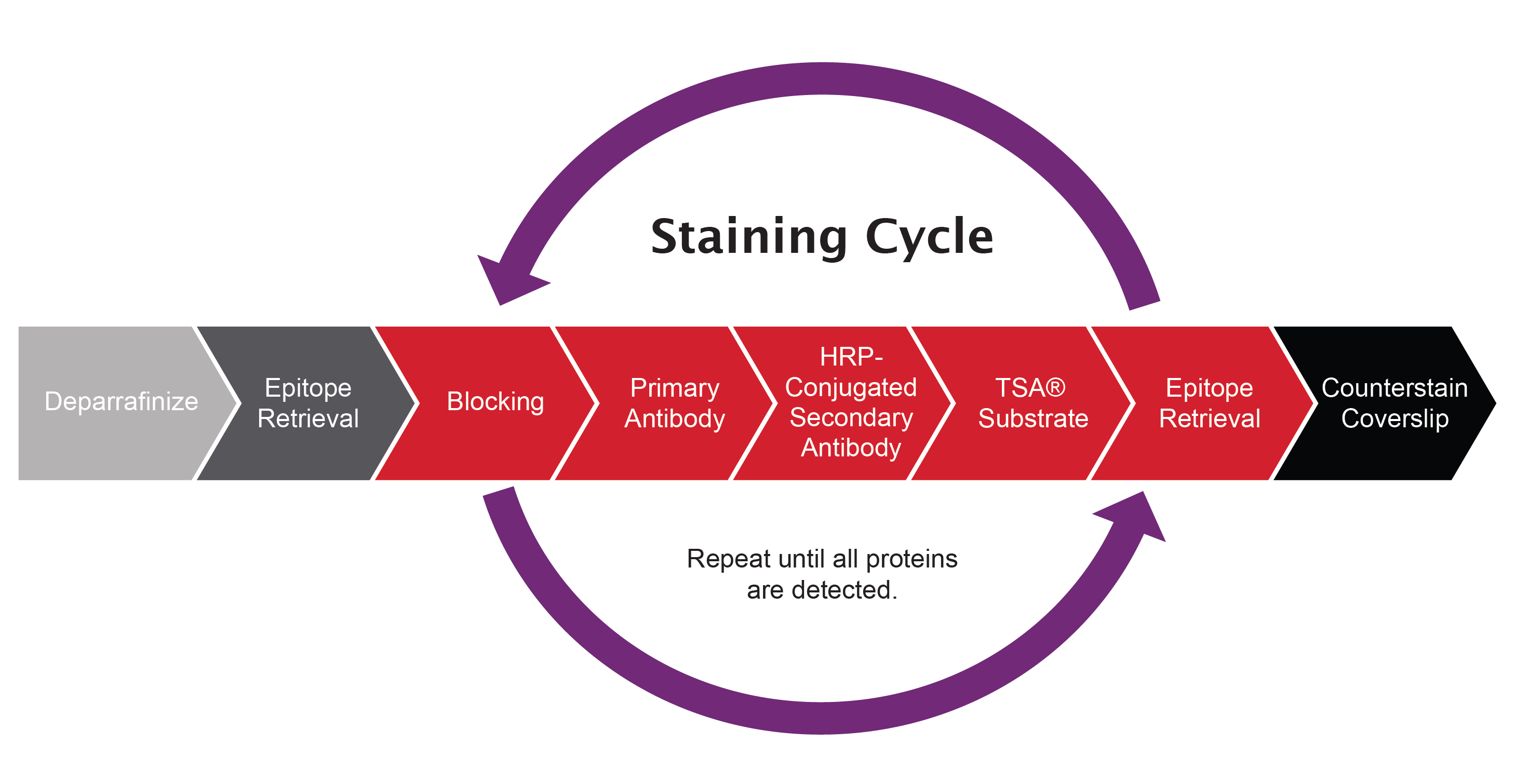
図1 mIFの染色サイクル
組織染色過程において、第一標的に対する一次および二次抗体を沈着させる。加熱洗浄(エピトープ回復)により抗体を組織から除去し、次の標的に対しての染色プロセスを繰り返し行う。本プロセスは、標的が標識されるまで繰り返し実行する。イメージング前の最終段階において、DAPIによる対比染色を行い、カバースリップで封入する。全てのタンパク質が検出されるまで繰り返し行う。
全てのmIFアッセイを良好に進めるためには、標的タンパク質ごとに高品質の免疫蛍光検証済み抗体を使用する必要があります。各抗体は、細心の注意を払って選別し検証をする必要があります。
経験則として、DAB基質を用いたシングルプレックス染色において、ほとんどバックグラウンドがないのにも関わらず特異的染色が得られない場合、マルチプレックス染色を行うことで複雑な問題が生じることが懸念されます。これはチラミド増幅過程では、欠損部分も増幅されるためです。シグナル/ノイズ比には、。組織による自己蛍光、標的タンパク質量が少ない、不十分なブロッキング、不十分な洗浄、一次および二次抗体の濃度が最適ではない、などの多くの要因に左右されます。これらの要因がうまく制御されていない場合、アッセイの質が損なわれる可能性があります。これらの問題を克服するためには、以下の4つの主要なパラメータが最適化されるよう、次の実用的なガイドラインを遵守することをお勧めします。
実験例
CD3e、CD8、CD20、CD68、およびPD-L1を一次抗体として使用し、検出システムにOpalを使用したBethyl社の検証結果を用いてグラフを作成し以下に示しました。
1.一次抗体の濃度
一次抗体の濃度を最適化するには、①DABで検出された抗体の染色パターンに関する知識、②TSA® 基質を用いたシグナルの最適化が必要です。強力なシグナルと好ましいシグナル/ノイズ比を得るには、ご自身で一次抗体の適切な希釈濃度を決定する必要があります。
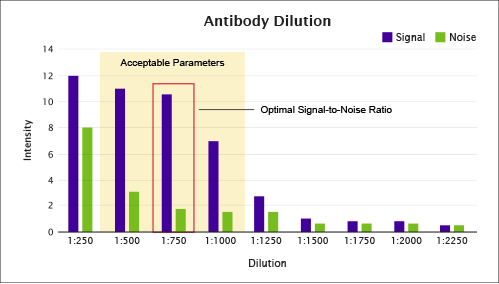
右に示した図2では、1:500〜1:1000の希釈において許容できるパラメータが得られ、特に1:750において最適なシグナル対ノイズ比(10:1)が得られています。1:250ではより高い強度のシグナルが得られていますが、この場合のシグナル対ノイズ比(1.5:1)は容認できません。
反対に、1:1250以上の希釈を行なった場合は十分な強度のシグナルが得られません。マルチプレックスで使用予定の各一次抗体に対して、このような最適化プロセスを行うことが重要です。最適な希釈は、① DAB染色パターンを再現し、②TSA®蛍光色素基質を用いて最も高いシグナル/ノイズ比を示す希釈です。
2.蛍光色素と抗体の最適な組み合わせ
各タンパク質に対応するシグナルがその他のものと区別でき、またチャネル間で顕著な重複がない場合、つまり、フィルターセットを構成する各チャネルが対象とする一次抗体に付随する一つの色に繋がる場合に、最適な結果が得られます。1つのチャネルで得られたシグナルが非常に高く、近接するチャネルのスペクトルと重なりが生ずると、重複したタンパク質の検出が損なわれる可能性があるため、近接チャネルを用いて複数タンパク質を検出する場合はこの点が特に重要となります。したがって、良好なシグナル/ノイズ比において、一次抗体と蛍光色素の適切な組み合わせを決定することが非常に重要となります。
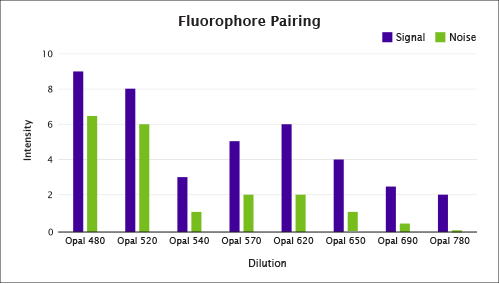
右の図3では、Opal 620蛍光色素が最適なシグナル/ノイズ比において、強力なシグナルを示しています。Opal 480と520蛍光色素も強いシグナルを示しているものの、これらは組織の自己蛍光による高いノイズを示しています。発現量の少ないタンパク質を検出するためには、その蛍光色素のイメージングに用いたフィルターセットによって観察される組織の自己蛍光と、画像システムにより検出される蛍光色素の能力のバランスをとることが、多くの場合で必要となります。
3.Opal濃度
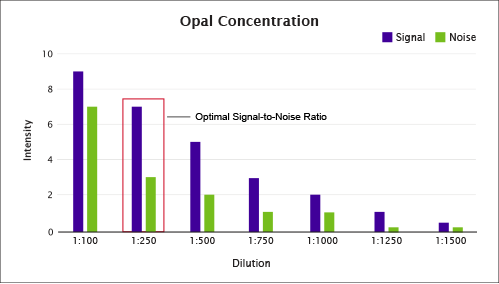
チラミド(TSA®)基質が多すぎると、余剰な蛍光色素が組織上に析出して、過剰なバックグラウンドを生じる可能性があります。図4では、1:250希釈において最良のシグナル対ノイズ比が得られています。近接するチャネルでイメージングされるタンパク質の検出と均衡をとるためにシグナルを低減させる必要がある場合には、1:500希釈も使うことができる点に留意します。
4.標的染色の最適な手順
TSA® を検出システムとして利用するmIFアッセイの過程では、連続的な繰り返し染色が必要であり、全ての標的が検出されるまで、抗体結合、蛍光色素沈着、および抗体除去を繰り返します。熱誘導性エピトープ回復(HIER)に組織を連続的に曝露することで、分解やエピトープ増強が生じると考えられます。HIERサイクルの影響は、どのエピトープに対しても予測ができません。そのため、最良の結果を得るためには染色の順番を決めることが重要です。
染色順を最適化するためには、検出するエピトープ分だけHIERサイクルを行いながらシングルプレックス染色をします。特に、上述のガイドラインに準じて決定した最適な抗体濃度と蛍光色素/抗体の組み合わせを利用して行うことが重要です。
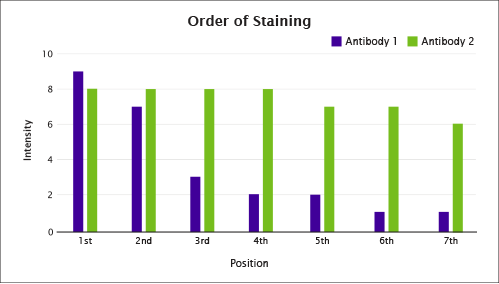
図5に、染色順の選定方法例を示しました。7種類のタンパク質を標的とするマルチプレックス染色において、どの抗体を3番目に染色するか決めたい場合、2回のHIERステップを実施し、シングルプレックス染色を行なった後、残りの4回のHIERステップを実施します。抗体1は、2回目の抗原回復後にシグナルの低下を示しました。したがって、抗体1は最初の2サイクルまでに使用する必要があり、それ以降に染色した場合はシグナルが低くなりすぎる可能性があります。これに対し、抗体2が産生するシグナルは繰り返されるHIERでもわずかに影響を受けているだけであり、7染色サイクル中のどの段階で使ってもよいといえます。
上述の4つの要因が最適化できれば、以下のプロトコルを用いて3つ以上の標的に対するmIFアッセイを実施することができます。電荷したスライドに対して、3〜5µmのパラフィン切片の使用を推奨します。
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては
使用しないように、十分ご注意ください。