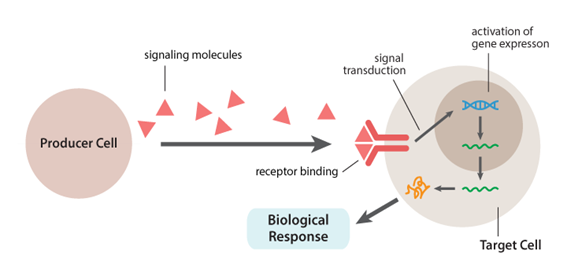
成長因子は、構造的・機能的特徴に基づいて、さまざまなファミリー/スーパーファミリーに分類されます。
・トランスフォーミング成長因子β(TGF-β)スーパーファミリー
TGF-βスーパーファミリーには、TGF-βタンパク質、骨形成タンパク質(BMPs)、成長分化因子(GDFs)、グリア由来神経栄養因子(GDNFs)、Activins、Inhibins、Nodal、Lefty、Mülllerian Inhibiting Substance(MIS)が含まれます(図2)。すべてのファミリーに共通しているのは、自身が二量体を形成する点、及び受容体がタイプIおよびタイプIIの受容体サブユニットからなるヘテロ二量体を形成している点です。リガンド結合後、II型受容体はI型受容体をリン酸化して活性化し、I型受容体はSmad依存性のシグナル伝達経路を活性化して、遺伝子の転写を制御します。TGF-βスーパーファミリーのメンバーは、形態形成、胚発生、成体幹細胞の分化、免疫制御、創傷治癒、炎症、癌などの様々な生物学的プロセスを多機能に制御しています(5)。
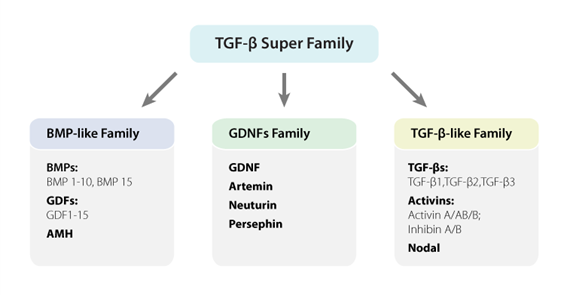
図2.TGF-βスーパーファミリー
・上皮細胞成長因子(EGF)ファミリー
EGFファミリーには、EGF、TGF-α、ニューレグリン、アンフィレグリン、ベタセルリンなどが含まれます。すべてのファミリーメンバーは、6つのシステイン残基を含む保存されたアミノ酸配列 (3つの分子内ジスルフィド結合を形成します) を1つ以上持っています。EGFファミリーのメンバーは、EGFR/ErbB受容体チロシンキナーゼを介して作用します。EGFファミリーのメンバーは、細胞の増殖、分化、生存を促進する能力でよく知られています。またEGFファミリーのメンバーとその受容体の制御異常は、腫瘍の発生と密接に関連していることが知られています(6)。
・血小板由来成長因子(PDGF)
血小板由来成長因子(PDGF)は、強力な細胞分裂促進および走化性タンパク質です。現在、4つの遺伝子(PDGFA、PDGFB、PDGFC、PDGFD)によってコードされる4つのPDGFタンパク質が知られています。PDGFは、活性化したマクロファージ、上皮細胞、内皮細胞、平滑筋細胞、活性化した血小板などの異なる細胞集団によって産生されます(7,8)。
PDGFは、PDGF-AA、PDGF-BB、PDGF-CC、PDGF-DD、PDGF-ABなどのジスルフィド結合したホモダイマーまたはヘテロダイマーとして分泌されます。PDGF受容体には、PDGFRαとPDGFRβというチロシンキナーゼ活性を持つ2つの受容体が知られていますが、いずれもヘテロ二量体やホモ二量体を形成することができます。リガンドの結合により受容体の二量体化、自己リン酸化が促進され、その結果、複数の下流の細胞内シグナルカスケードが活性化されます。
PDGFRαを介したシグナル伝達は、顔面骨格、毛包、精子形成、肺、腸の絨毛の発生に重要で、PDGFRβを介したシグナル伝達は、血管、腎臓、白色脂肪細胞の発生に重要です(9)。このように、PDGFは初期発生、創傷治癒、血管新生に不可欠です。PDGFアイソフォームの調節と産生の異常が、腫瘍、血管疾患、線維性疾患の原因となることは注目に値します。
・線維芽細胞増殖因子(FGF)ファミリー
ヒトでは、FGFファミリーの22のメンバーが同定されており、その全てがヘパリン結合タンパク質です。細胞表面に存在するヘパラン硫酸プロテオグリカンとの高親和性の相互作用は、受容体チロシンキナーゼを介したFGFのシグナル伝達に不可欠です(10)。FGFは多能性タンパク質であり、主に細胞分裂促進作用がありますが、形態形成作用、内分泌作用等も持っています。FGFは、胚の発生過程(9)、成熟した組織・システムの血管新生(11)、ケラチノサイトの組織化(12)、創傷治癒過程(13)等に関与していることが知られています。
・インスリン様成長因子(IGF)
インスリン様成長因子(IGF)は、インスリンと高い配列類似性を持つタンパク質です。IGF受容体は、細胞質にチロシンキナーゼドメインを持つ、ジスルフィド結合したヘテロ4量体の膜貫通型タンパク質です。IGF受容体には、IGFI-RとIGFII-Rの2種類があります。IGFの利用は、IGF Binding Protein1-6によって制御されます(14)。IGFの主な作用は細胞の成長です。実際、下垂体成長ホルモンの作用のほとんどは、IGF、主にIGF-1によって媒介されています。成長ホルモンは多くの組織、特に肝臓を刺激してIGF-1を合成・分泌させ、その結果、骨を含むほとんどの組織で肥大(細胞サイズの増加)と過形成(細胞数の増加)を刺激します。また、IGFはニューロンの生存を誘導したり、軟骨細胞を保護したり、骨細胞を活性化したりもします(15)。
・血管内皮細胞増殖因子(VEGFs)
VEGFは、内皮細胞に特異的なホモ二量体の糖タンパク質成長因子です(16)。VEGFは、血管新生と血管透過性を制御し、特に胚発生、骨格の成長、生殖機能において重要な役割を果たしています。また、造血においても重要な役割を果たしています。VEGFは、主にチロシンキナーゼVEGFR1およびVEGFR2を介してシグナルを伝達し、細胞の生存、増殖、移動、および/または接着を刺激します(17)。VEGFの調節不全は、腫瘍、眼内血管障害、その他の疾患と関連していることが知られています(16)。VEGF遺伝子ファミリーのメンバーには、VEGF/VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E、VEGF-F、およびPlacental Growth Factor (PlGF)が含まれます(18)。
・肝細胞増殖因子(HGF)
HGFは間葉系細胞から分泌され、主に上皮や内皮由来の細胞に対する多機能なサイトカインとして作用します。HGFは、HGFRを介してチロシンキナーゼのシグナルカスケードを活性化することにより、細胞の成長、細胞の運動性、形態形成を制御します(19)。HGFは、胚の器官形成、成人の器官再生、および創傷治癒に大きな役割を果たすことが示されています。さらに、HGFは細胞分裂、細胞運動、マトリックスへの侵入を促進する能力を持ち、血管新生や腫瘍形成において中心的な役割を果たしていることが報告されています(20)。
・腫瘍壊死因子(TNF)
腫瘍細胞のアポトーシスに関与することが知られているサイトカインは、当初、腫瘍壊死因子(またはTNFファミリー)として分類されていました。すべてのTNFファミリーメンバーは、「TNFホモロジードメイン」(THD)と呼ばれる三量体の保存されたC末端ドメインを持っています。受容体との結合に関与するTHDは、ファミリーメンバー間で約20〜30%の配列同一性があります。ほとんどのリガンドは膜結合タンパク質として合成され、タンパク質分解によって切り離されることで可溶性となります(21)。最初に同定されたファミリーのメンバーはTNFαとTNFβでした。現在までに、19種類のTNFスーパーファミリーリガンドと32種類のTNFスーパーファミリー受容体が同定されています。多くのTNFスーパーファミリーのメンバーは、アポトーシスを促進または抑制に関わる一方で、ナチュラルキラー細胞の活性化、T細胞の共刺激、B細胞のホメオスタシスと活性化など、自然免疫系と獲得免疫系の両方において重要な機能を制御しています(22)。 さらに、いくつかのTNFスーパーファミリーのメンバーは、卵胞のアポトーシス(23)や破骨細胞の発生(24)などの細胞タイプ特異的な反応を制御していることが知られています。
・インターロイキン(IL)
インターロイキン(IL) は、免疫応答時に免疫系や造血系の細胞の成長、分化、活性化を制御する免疫調節タンパク質の一種です。ILは、ケモカインやインターフェロン(IFN)とは異なります。ケモカインは、走化性を介して免疫細胞を炎症部位に誘導することが主な機能であり、インターフェロン(IFN)は、主にウイルス感染に対する細胞応答を媒介します。ILは、炎症を促進する作用や抗炎症作用を発揮することから、病原体に対する宿主の防御に不可欠です。既知のILは、その構造上の特徴から、IL1様サイトカイン、クラスIヘリカルサイトカイン(IL4様、γ鎖、IL6/12様)、クラスIIヘリカルサイトカイン(IL10様、IL28様)、IL17様サイトカインの4つのグループに大別されます(表1)。さらに、独自の構造的特徴を持つインターロイキンも多数存在します。インターロイキンは、その種類によって機能が異なります。例えば、IL1とIL2は主にTリンパ球とBリンパ球を活性化する働きがあり、IL2はT細胞とB細胞の成長と成熟を促進する働きがあるとされている。また、IL1はIL6と並んで、炎症の媒介因子として働きます。IL4はBリンパ球の抗体分泌を増加させ、IL12は細胞傷害性T細胞やナチュラルキラー細胞の産生を促進します。ILは主に白血球から分泌されますが、ケラチノサイト、軟骨細胞、線維芽細胞、内皮細胞、上皮細胞、平滑筋細胞など、他の関連する非免疫細胞からも分泌されることがあります。
表1.インターロイキンの分類
| グループ |
遺伝子 |
共通点と構造的モチーフ |
| IL1-like |
IL1A, IL1B, IL1RN, IL1F5, IL1F6, IL1F7, IL1F8, IL1F9, IL1F10, IL18, IL33 |
Fold rich in B-strand known as a B-trefoil |
| γ-chain utilizing |
IL2, IL4, IL7, IL9, IL15, IL21, TSPL |
Four tightly packed α-helices known as “four- helix bundle” motif; receptor complex contains γc chain subunit |
| IL4-like |
IL3, IL4, IL5, IL13, CSF2 |
Four tightly packed α-helices known as “four- helix bundle” motif; shorter core helices |
| IL6/12-like
| IL6, IL11, IL12A, IL23A, IL27A, IL31, CLCF1, CNTF, CTF1, LIF, OSM, CSF3 |
Four tightly packed α-helices known as “four- helix bundle” motif; longer core helices |
| IL10-like |
IL10, IL19, IL20, IL22, IL24, IL26 |
“Bundle helix” structural motif containing six or seven stacked helices |
| IL28-like |
IL28A, IL28B, IL29 |
“Bundle helix” structural motif containing six or seven stacked helices |
| IL17-like |
IL17A, IL17B, IL17C, IL17D, IL25, IL17F |
Neurotrophin-like cysteine-knot fold |
| Non-classified |
IL8, TXLNA, IL16, IL32, IL34, CSF1 |
Varies |
(Adapted from: Human IL classification. Human Genomics website. http://www.humgenomics.com/content/5/1/30/table/T2. Accessed September 1, 2015)
・インターフェロン(IFN)
インターフェロン(IFN) は、ウイルス、細菌、寄生虫、腫瘍細胞などの病原体の存在に反応して宿主細胞で作られ、放出されるシグナル伝達タンパク質のグループです。IFNは病原体に直接作用するのではなく、感染した細胞やその近くにある細胞を刺激して、病原体の複製や増殖を防ぐタンパク質を産生させます。また、インターフェロンは、B細胞の活性化を抑制し、T細胞の活性を高め、ナチュラルキラー細胞の細胞破壊能力を高めるなど、免疫調整機能も持っています。 ヒトを含む動物では、20種類以上のIFN遺伝子とタンパク質が同定されており、 これらは一般的に I型IFN とタ II型IFNの2つのクラスに分けられます。 I型IFNは、ウイルス性IFNとしても知られており、IFN-α、IFN-β、IFN-ωが含まれます。 II型 IFNは、免疫性IFN(IFN-γ)としても知られています。 ウイルス性IFNはウイルス感染によって誘導されるのに対し、II型IFNは細胞分裂刺激や抗原刺激によって誘導されます。 ほとんどのタイプのウイルス感染細胞は、I型IFNを合成します。一方、IFN-γは、ナチュラルキラー細胞、CD4 Th1細胞など、免疫系の特定の細胞でのみ合成されます(26)。
・コロニー刺激因子(CSF)
コロニー刺激因子(CSF)は、分泌される糖タンパク質で、造血幹細胞の表面にある受容体タンパク質と結合し、細胞内のシグナル伝達経路を活性化することで、細胞を増殖させ、特定の種類の血液細胞(通常は白血球)に分化させます。このようにして、CSFは、がん治療の副作用を軽減したり、感染症のリスクを低減したりします。CSFにはCSF1、CSF2、CSF3の3つのタイプがあります。CSF1は、単球とマクロファージ前駆体の成長と成熟を促進します。また、ヒトマクロファージ/単球の食作用および殺腫瘍活性を高め、様々な異なるサイトカインを分泌するように誘導します。CSF2は、造血前駆細胞の成長と分化を促進することが知られており、CSF3は、顆粒球、単球、マクロファージの産生、分化、機能を制御することで造血に関与しています。