野中隆 先生
総説:αシヌクレイン凝集体の立体構造とプリオン様性質
野中隆 先生
はじめに
近年、クライオ電子顕微鏡によるタンパク質の立体構造の解析技術が著しい進歩を遂げており、これまで解析が困難であった様々なタンパク質の立体構造が明らかにされている。中でもタンパク質凝集体の構造解析法の技術革新に伴い、神経変性疾患の患者脳に出現する疾患特異的なタンパク質凝集体が次々と解析され、タウ、αシヌクレイン(αS)およびTDP-43 の細胞内凝集体の特徴的な立体構造がそれぞれ明らかにされた。これらの細胞内凝集体は、プリオン病における異常プリオンタンパク質と同様な性質を有し、細胞間を伝播することが多数報告されている。「タンパク質凝集体の細胞間伝播」は、病気の進行に伴って異常病理が脳内を進展するメカニズムとして提唱されており、その立体構造と機能が相関する可能性が示唆される。本稿では、αS凝集体の立体構造とプリオン様活性に関する我々の最新の研究成果について紹介する。
クライオ電子顕微鏡によるαS凝集体の立体構造解析
クライオ電子顕微鏡によるタンパク質の立体構造の解析技術はここ数年で著しい進歩を遂げており、この解析手法を用いることで、神経変性疾患の患者脳に蓄積したタンパク質凝集体の構造が次々と解明されている。
2017 年には、MRC分子生物学研究所のGoedert およびScheresらが、アルツハイマー病患者脳より調製した界面活性剤不溶性画分を試料としてクライオ電子顕微鏡による解析を行い、脳内で不溶化したタウの立体構造を世界で初めて明らかにした1)。さらに同グループは、患者脳より調製した不溶化αS(図1)あるいはTDP-43を用いてこれらの立体構造も次々と明らかにしている2, 3)。αSに関しては、患者脳に蓄積した不溶化αSのみならず、リコンビナントαS凝集体の構造も明らかとなった4)。興味深いことに、患者脳由来の不溶化αSとリコンビナントαS凝集体はいずれも2分子のプロトフィラメント(PF)と呼ばれるアミロイド線維の前駆体からなる中核構造(図1)をとっているが、両者の立体構造は互いに異なっている。
また、αSが蓄積する疾患であるαシヌクレイノパチーにおいて、疾患ごとに蓄積したαSの構造が異なる可能性が示された2)。以前から、αシヌクレイノパチーの一種である多系統萎縮症の患者脳由来の不溶化αSのプリオン様活性は、パーキンソン病の患者脳由来の不溶化αSの活性よりも高いことが報告されており5)、両者の構造の違いとプリオン様活性が相関することが示唆される。
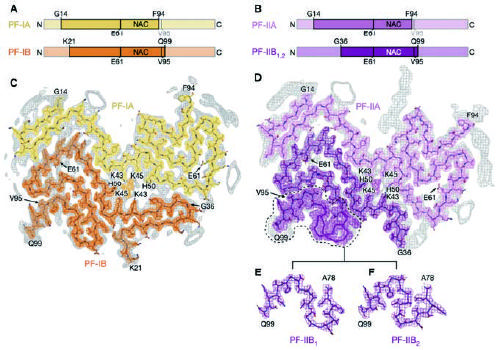
図1 クライオ電子顕微鏡解析によるαS凝集体の立体構造
多系統萎縮症(MSA)患者脳より調製したαS凝集体の構造(2種類の構造)が明らかとなり、それぞれ2分子のαSプロトフィラメント(アミロイド線維前駆体 : PF)が相互作用した中核構造を有している。
1つ目(AおよびC)は、Gly14-Phe94およびLys21-Gln99の2種類のPFからなる構造である。
2つ目(BおよびD)は、Gly14-Phe94およびGly36-Gln99の2種類のPFからなる構造であるが、こちらは
Gly36-Gln99のPFの一部が少々異なるコンフォーメーションをとっていた(EおよびF)。
変異型αSの解析
我々は、患者脳由来およびリコンビナントαS凝集体ではいずれも2分子のPFが相互作用していることから、これが凝集体形成に重要であると考えた。さらにその相互作用領域には特徴的なアミノ酸が存在することに着目し、それらを他のアミノ酸に置換した変異体(変異型A および変異型B)を作製し、それらの凝集や細胞内蓄積に関して野生型と比較した。
2種類のリコンビナント変異型および野生型αSモノマーを作製し、それらを37℃で7日間振盪した。経時的に試料の一部を採取し、チオフラビンT(ThT)アッセイにより凝集体形成を測定した。その結果、野生型および変異型αSではいずれも経時的にThT の蛍光強度が増加し、野生型のみならず変異型αSモノマーも経時的に凝集することが判明した。各々の凝集体を電子顕微鏡で観察したところ、いずれの試料においても線維状の構造物が観察された。
次に、これらのαS凝集体がシード(凝集核)として機能するかどうかについて検討した。野生型αSモノマーを37℃で振盪せずにそのまま静置しても凝集体形成はほとんど認められないが、静置したモノマー溶液に予め作製しておいた野生型凝集体を添加すると、野生型モノマーは経時的に凝集し、添加した凝集体がシードとして機能することが知られている6)。そこで、今回作製した2種類の変異型αS凝集体について同様のアッセイを行った。野生型モノマーに変異型A凝集体を添加すると、野生型モノマーは経時的に凝集し、そのシード効果は野生型凝集体よりも強かった。一方、変異型B凝集体を野生型モノマーに添加したところ、経時的な凝集体形成は全く認められず、変異型B凝集体にはシード活性がほとんどないことが明らかとなった(図2)。
このシード活性について、αシヌクレイン凝集アッセイキット( 品番 : SYN01)を用いて検討を行った。SHSY5Y細胞に野生型αSプラスミドを一過性に発現させ、一晩培養した。その後、野生型あるいは変異型凝集体を細胞内に導入して、プラスミド由来の野生型αSが細胞内で蓄積するかどうかについて調べた。その結果、シードを添加しない場合には細胞内においてプラスミド由来αSは全く蓄積しなかったが、野生型あるいは変異型A凝集体を導入した場合には、著しい細胞内蓄積が観察された。一方、変異型B凝集体を細胞に導入した場合には、αSの細胞内蓄積はほとんど生じなかった。
さらに、これらの凝集体をマウス脳にインジェクションして、内在性のマウスαS がシード依存的に脳内で蓄積するかどうかについて検討した。マウス脳に10 µgの凝集体をインジェクションして3ヵ月経過した後に脳を取り出し、免疫組織化学解析を行った。その結果、in vitroの実験結果と同様に、変異型A凝集体をインジェクションするとシード依存的な内在性αSの蓄積は野生型を上回っており、変異型B凝集体を用いたマウス脳ではその蓄積はほとんど観察されなかった。
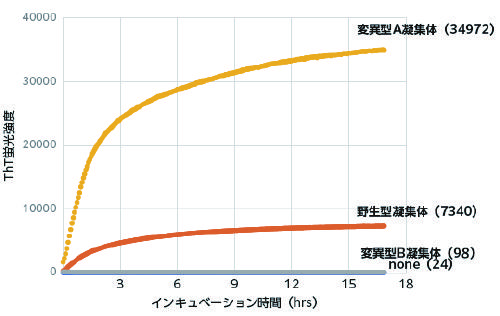
図2 in vitroにおけるαS凝集体のシード活性
野生型αSモノマー溶液(1 mg/mL、100 µL)、凝集体(野生型、変異型Aおよび変異型B:各々1 µg)およびThTを混合し、37℃でインキュベーションした。反応液の蛍光強度は、442 nmの励起波長および485 nmの蛍光波長にて連続的に測定した。
野生型モノマーのみ(none)を37℃でインキュベーションしてもThTの蛍光強度は増加(凝集)しないが、そこに野生型あるいは変異型A凝集体を添加すると、モノマーはシード依存的に凝集した。一方で、変異型B凝集体を添加してもモノマーは全く凝集しなかった。カッコ内の数値は、最終計測時点での蛍光値を示した。
変異型αS凝集体の有用性
以上の結果より、今回変異を導入したαS の領域は、その線維化・凝集体形成にはそれほど関与はないが、凝集体のシード活性に大きく関与することが示された。特に変異型A凝集体では野生型よりもシード効果が強く見られたことから、この凝集体を用いることにより、αS 蓄積を伴う細胞あるいはin vivo動物モデルを効率良く作製できると考えられるため、今後の製品化を目指している。なお、野生型凝集体であるαシヌクレイン線維化タンパク質(ヒト型)(品番 : SYN03)については、コスモ・バイオにて現在販売されている。
また、シード活性がほとんど認められなかった変異型B凝集体に関しては、野生型凝集体よりもプリオン様活性(病原性)が低いとも考えられるため、αシヌクレイノパチーに対する免疫療法として利用できる可能性があり、その有用性について検討していく。
- Fitzpatrick AWP.et al.: Cryo-EM structures of tau filaments from Alzheimer's disease. Nature 547(7662):185-190 (2017)
- Schweighauser M.et al.: Structures of α-synuclein filaments from multiple system atrophy. Nature 585(7825):464-469 (2020)
- Arseni D.et al.: Structure of pathological TDP-43 filaments from ALS with FTLD. Nature 601(7891):139-143 (2022)
- Guerrero-Ferreira R. et al.: New insights on the structure of alpha-synuclein fibrilsusing cryo-electron microscopy. Current Opinion in Neurobiology. 61:89-95
- Prusiner SB.et al.: Evidence for α-synuclein prions causing multiple system atrophy in humans with parkinsonism. Proc Natl Acad Sci U S A. 112E5308-5317 (2015)
- Woodet al.: alpha-synuclein fibrillogenesis is nucleation-dependent. Implications for the pathogenesis of Parkinson's disease. J. Biol. Chem. 274:19509-19512
【関連製品】
- α-シヌクレイン凝集アッセイキット [CSR]
α-シヌクレイン 凝集アッセイキットは、α-シヌクレインの凝集体形成を細胞内で再現するモデルであり、in vitro における有効成分のスクリーニングが可能です。 - α-シヌクレイン線維化タンパク質 [CSR]
α-品番SYN01 のα- シヌクレイン線維化タンパク質単品商品。in vivo にも使用可能です。 - α-シヌクレインリコンビナントタンパク質 [CSR]
- α-シヌクレイン抗体 [CAC]
主にパーキンソン病(PD)、レビー小体型認知症(DLB)、多系統萎縮症(MSA) 研究に
【関連情報】
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する












