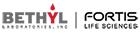免疫チェックポイントの阻害は、この十数年で多くの種類のがんに対する治療法の候補として挙げられてきました。免疫療法は、がん細胞は免疫細胞に浸潤されるが、がん細胞による阻害シグナルにより免疫細胞の機能が制限され、効果的にがん細胞を排除できない事に基づく治療法です。免疫療法は、T細胞の機能をブロックするという阻害シグナルを逆手に取ることで、がん細胞に既に湿潤している免疫細胞を再活性化し、その機能を取り戻させます(1)。
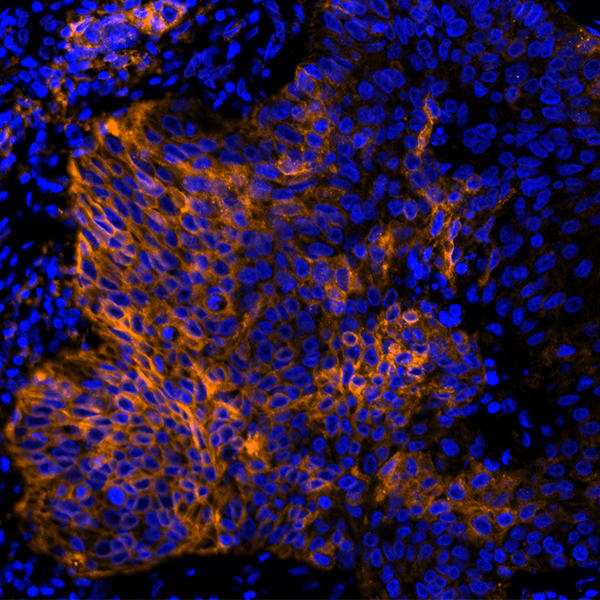
治療の標的とされ、よく知られているチェックポイントにPD-1/PD-L1経路があります。2017年には、PD-1/PD-L1経路を標的としたいくつかの薬物がFDAに承認されました(2)。PD-1はT細胞に見られる受容体で、慢性的な抗原刺激で見られる枯渇したT細胞上で上方制御されます(3)。がん細胞は抗原豊富な状態であり、腫瘍浸潤性T細胞や腫瘍浸潤リンパ球は頻繁かつ急速にPD-1が上方制御されています。多くのがん細胞はその表面にPD-L1を発現しています(4,5)。がん細胞のPD-L1とT細胞のPD-1の相互作用は、T細胞に制御シグナルを伝達します(6)。そのため、PD-L1とPD-1の相互作用をブロックすることは、腫瘍浸潤リンパ球のエフェクター機能を上昇させ、患者の無増悪進行生存期間や全生存期間を延長する抗腫瘍免疫反応を誘導します(7)。
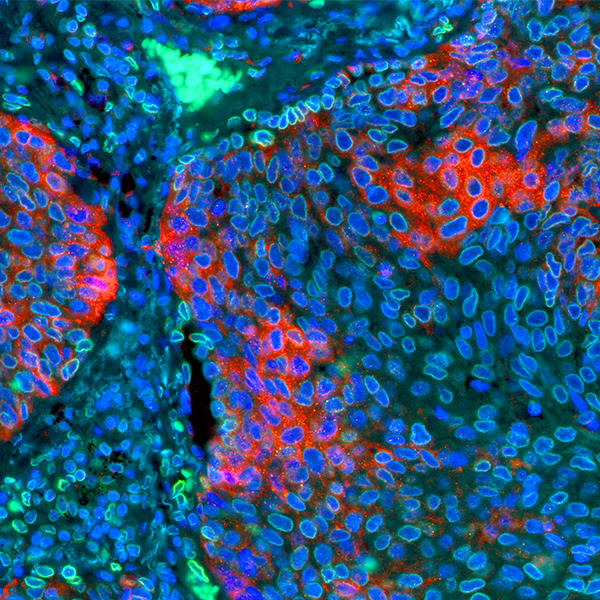
抗PD-1治療の成功につづき、複数のチェックポイント阻害剤が試験されています。これらの経路を介したシグナル伝達は、PD-1の下流のT細胞に同様の阻害効果を与えます。T細胞はLAG-3やBTLA、TIM-3、TIGITの受容体を用いて、抗原に対する応答を下方制御します。そして、これらの受容体は新規治療薬の候補として挙げられており、いくつかのレビューで新規チェックポイントの可能性がハイライトされました(8,9)。これらの受容体に対するリガンドは、PD-L1同様にがん細胞の表面もしくは抗原提示細胞で見られ、これらのシグナル伝達経路による腫瘍浸潤リンパ球の阻害は腫瘍内で起こると考えられています。実際、これらの受容体を標的とする治療法に対する特許が世界中で申請されています。
新規のチェックポイント阻害療法(免疫治療)の開発を続ける最も大きな理由の1つは、一部の患者だけPD-1/PD-L1やCTLA4の阻害に応答する事、また、その患者もこの療法に対する耐性が発生する可能性があるからです(10,11)。例えば、一部の患者では、これらの治療法に対する生物学的逃避機序により特定のチェックポイントマーカーの発現量が減少しますが、同様の細胞機能を有する他の分子が同様の効果を得るために治療の標的とされます(12)。免疫療法の新しい波が押し寄せ、がん治療のために免疫系の多くの因子が標的となる、そのような可能性が目の当たりにできます。
Cosmo Bio would like to acknowledge and thank the Bethyl Laboratories Inc. and Dr.Aliyah Weinstein for providing PD-1 information presented here.























 このページを印刷する
このページを印刷する