|
今野 歩1,2先生 1 群馬大学大学院 医学系研究科 脳神経再生医学分野 |
OptiPrep™を用いた密度勾配超遠心分離法によるAAVベクターの精製
ユーザーレポート
Products
- OptiPrep™ (オプティプレップ)多用途密度勾配遠心分離媒体(品番:1893)
メーカー:Serumwerk Bernburg AG メーカー略号:SEW

■ OptiPrep™ (オプティプレップ)多用途密度勾配遠心分離媒体
エクソソームや組換えウイルスの分離に
60% Iodixanol(イオジキサノール)溶液として提供されている、遠心分離媒体

Iodixanolは、密度勾配分離の媒体としてよく利用されているショ糖に比べて粘性が低いため、取り扱いが簡単です。
また、ショ糖や塩化セシウムよりも浸透圧を低く保つことができるため、小胞や細胞へのダメージを抑えることが可能です。
実験内容
はじめに
近年、ウイルスの持つ高効率な感染能を利用し、生きた生物個体に高効率に遺伝子を送達できるウイルスベクターが遺伝子治療や脳神経科学の研究において注目さている。特に、アデノ随伴ウイルス(AAV)ベクターに関しては、単独感染での病原性が知られていない点や免疫原性が低い点などから利用が急速に広がっている。著者は2011年に群馬大学に異動してから、日本医科大学の島田隆先生および三宅弘一先生よりご教示いただいたプロトコールに基づき、研究室内でAAVベクターの作製系を新規に立ち上げ、15年近くにわたりAAVベクターの技術開発研究を推進してきた。この間、AAVベクター作製プロトコールに関して、トランスフェクションや培地の濃縮方法など様々な改変を加えてきた(トランスフェクションはリン酸カルシウム方からポリエチレンイミン[PEI]を用いた方法へ;濃縮は硫安沈殿から、PEG8000を用いた方法へ)。しかしながら、AAVベクターの精製の要である密度勾配超遠心の溶媒は一貫して、OptiPrep™(60% Iodixanol[イオジキサノール]溶液、Serumwerk Bernburg社、品番:1893)を使用している。本Application Noteでは、著者が長年お世話になっているOptiPrep™に関して、AAVベクターの精製への応用例を紹介する。
AAVベクターの産生と中空粒子の問題
一般的にAAVベクターを産生する場合、図1に示すようにHEK293(T)細胞へのTriple Transfectionにより実施する1。AAVベクターの産生には、AAV由来のRep/Cap(レプリカーゼ/カプシド)遺伝子の他に、アデノウイルス由来の遺伝子(E1A, E1B, E2A, E4, VA)が必要となる。HEK293(T)細胞には株化の際に導入されたE1AおよびE1Bが含まれているため、残りの3遺伝子を含むpHelperプラスミドを、pAAVプラスミド、Rep/CapプラスミドとともにTransfectionする。これにより、細胞内でAAV産生に必要なすべての遺伝子が揃い、 ITR間がゲノムとして切り出されたAAVベクターが産生される。この際、ゲノムを含む本来のAAVベクター(完全粒子やフルカプシド[full capsid]とも呼ぶ)の他に、中にゲノムを含まない中空粒子(空ベクターやエンプティカプシド[empty capsid]とも呼ぶ)が、完全粒子の3~30倍もの量で産生されることが知られている2。この中空粒子は遺伝子発現に寄与しない一方で、表面上の構造は完全粒子と同一であり、感染受容体への結合能などは保持している。このため、大量に混入した中空粒子は競争阻害を起こす可能性があるうえ、不要な免疫反応や副作用の原因になるともされており、できる限り取り除くことが望ましい3,4。これらの中空粒子の除去はアフィニティークロマトグラフィー法などでは難しく、完全粒子と中空粒子の密度差を利用した密度勾配遠心分離法での除去が必要となる。
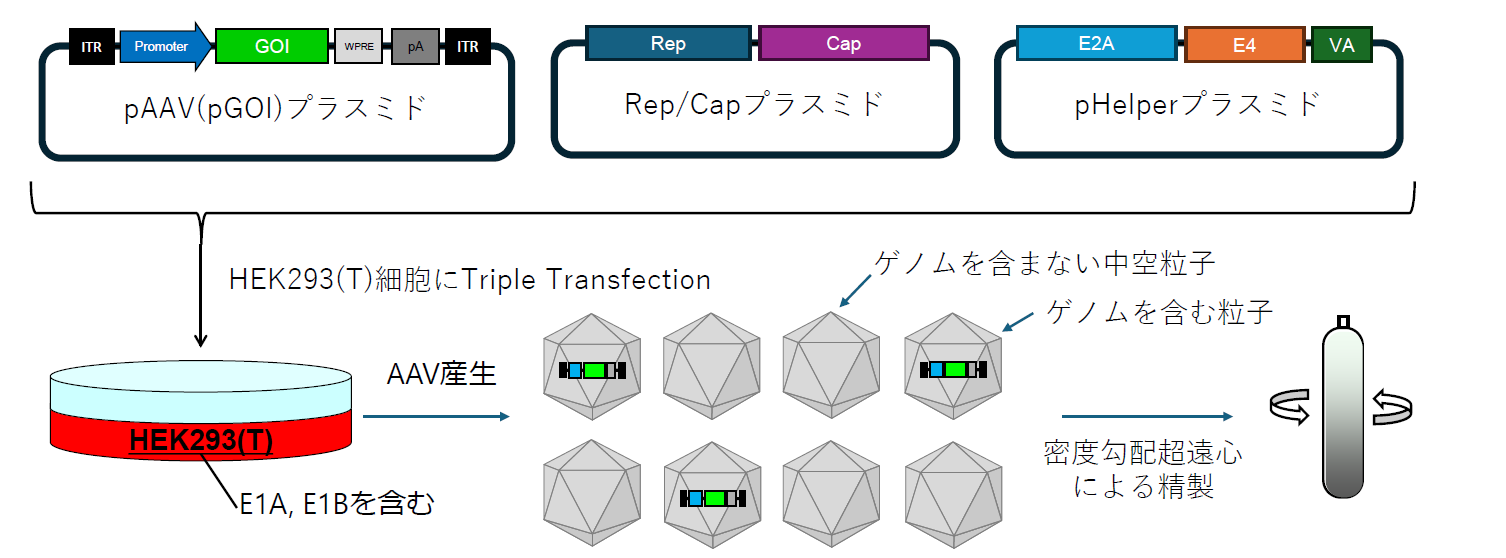
図1 AAVベクターの産生
AAVベクターの産生にはAAV由来のRep/Cap遺伝子の他に、アデノウイルス由来の遺伝子(E1A, E1B, E2A, E4, VA)が必要となる。HEK293(T)細胞には株化の際に導入されたE1AおよびE1Bが含まれているため、残りの3遺伝子を含むpHelperプラスミドを、pAAVプラスミド・Rep/CapプラスミドとともにTransfectionする。これにより、細胞内でAAV産生に必要なすべての遺伝子が揃い、 ITR間がゲノムとして切り出されたAAVベクターが産生される。
密度勾配超遠心の溶媒としてのOptiPrep™
AAVベクターの密度勾配遠心分離法による精製に関して、以前は塩化セシウム(CsCl)溶液が溶媒として使用されていた。しかしながら、今では多くの研究者が、OptiPrep™を使用しているというのが著者の認識である。CsClとOptiPrep™を比較した場合、大きく分けて2つの利点がある。1点目は精製時間に関する点である。CsClを用いた密度勾配超遠心では精製効率があまり高くないため、特にin vivoでの使用の場合、2回の超遠心を実施する必要があった。しかしながら、OptiPrep™を使用した場合は、1回の超遠心で十分な純度が得られる5-7。これによりOptiPrep™を使用した場合にはCsClを使用した場合と比べ、時間を大幅に短縮できるうえ、収率も高い。2点目は毒性の問題である。CsClは毒性が高いため、密度勾配遠心による分離のあとに透析によるCsClの完全な除去が必要であった。一方で、OptiPrep™を細胞毒性が低く、そのままin vivoでの使用も可能であり、以前は著者らもOptiPrep™の除去を経ることなく、そのまま希釈したものを用いていた。ただし最近では、粘性の高さへの懸念から、限外濾過膜を使用したOptiPrep™の除去とPBSへの置換作業を行っているが、その作業にかかる時間はそれほど長くない。次の項では著者らが現在実際に実施している、OptiPrep™を用いたAAVベクターの精製について、特に密度勾配超遠心による精製部分について具体的なプロトコールを示す。
AAVベクター作製プロトコール
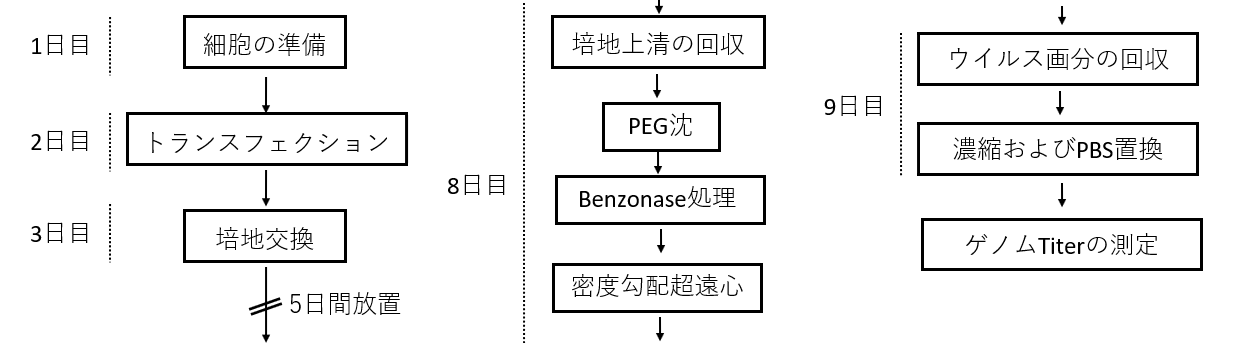
AAVベクターの作製方法に関する詳しい内容は、以前に羊土社の「実験医学別冊 決定版 ウイルスベクターによる遺伝子導入実験ガイド」に詳しく記載したので、そちらをご参照いただければ幸いである。ここでは、全体の大まかなワークフロー(図2)とOptiPrep™を用いた密度勾配遠心分離法による精製部分に特にフォーカスを当てて解説する。
1日目
- AAVベクターの作製には大量の細胞が必要なため、大きめのディッシュに細胞を播種する。著者らは、24.5 cm square dish(住友ベークライト社、品番:MS-12400)を使用している。
2日目
- 図1に示した3種類のPlasmidをPEI(Polyethylenimine “Max”、 Polysciences社、品番:24765-1)を用いてTransfectionする。
3日目
- FBSなしのD-MEMに培地交換を行う。
- 低栄養条件下で長期間培養することによりAAVベクターが培地中に放出される。著者らは5日間放置している。
(※AAV2など、一部培地中に放出されにくい血清型があるので、その場合は、細胞内からも回収する必要がある)
8日目
- 培地を全量回収し、2,000 rpmで5分遠心することにより死細胞や細胞片を除く。
- 終濃度が8% PEG 8000/0.5 M NaClとなるように40% PEG8000/2.5 M NaClを加えて、氷上で2時間放置する。
(※または4℃に保存しオーバーナイト。4℃で数日放置可能。) - 遠心3,200g,30分,4℃
- 上清を捨て、沈殿を、MgCl2を含むPBSで再懸濁し、Benzonase(メルクミリポア社、品番:70746-3)処理を行う。
- Benzonase処理が完了した溶液を超遠心チューブ(エッペンドルフ社、品番:345321A)に注入する。
(※著者らが使用している超遠心チューブは、首の部分が狭いため、注入には吸上針[翼工業社、16G×105 mm、特注品]を使用している。) - OptiPrep™を吸上針(14G[OptiPrep™ は粘性が高いため、太めの吸上針を使用している])で超遠心チューブの底面側から重層する(図3B;界面を乱さないように注意する)。
- 超遠心チューブをチューブシーラー(エッペンドルフ・ハイマック・テクノロジーズ社、品番:STF-2)でシールする(図3C)。
- Gradient Master(Biocomp Instruments社、品番:108)に超遠心チューブをセットし、Angle 80°、Speed 20 rpm、Time 3 minの条件で、連続グラジエント作製する(図3D)。
(※著者らは連続グラジエント法を用いているが、非連続グラジエント法を用いる場合、60%・40%・25%・15%等のOptiPrep™溶液を準備し、順番に重層する。超遠心後、AAVベクター粒子は40%の層に含まれる。詳しい手法は、他の文献7やaddgeneのウェブサイト を参照されたい。)
を参照されたい。) - グラジエントを作製したチューブを、バーティカル形ロータ P50VT2にセットし、超遠心機CP 80NXもしくはCP80WX(ロータ・超遠心機ともに、エッペンドルフ・ハイマック・テクノロジーズ社製)にて、36,000 rpm(107,200 xg[avg])、16℃、15時間、DECEL=0の設定で超遠心を行う(図3E)。DECELの条件を「0」に設定する事により、1,000 rpmまではブレーキをかけるが、それ以降は自然減速によりロータが止まるようになる。この設定により、超遠心後の分離層の乱れを防ぐことができる。
9日目
- Fraction Recovery System(Beckman Coulter社、品番:342023)に超遠心チューブをセットする(図3F)。
- 遠心チューブの下部から針を刺し、最下部4 mlを廃液として捨てて、その上5 mlをウイルス溶液として回収する(図3H)。(※著者らの環境では経験的にこの部分にAAVベクター粒子が集まることが分かっているため、簡易的にこの部分を回収する。)
- 回収した5 mLのウイルス溶液をVivaspin Turbo 15 PES(Sartorius社、品番:VS15T42)を用いて、濃縮およびPBS置換を行う。
- 調製したAAVベクター溶液の粒子数の測定には、定量PCRを使用する。AAV粒子1個あたり、1つのゲノムDNAが含まれているため、作製に用いた発現Plasmidを基準として、絶対定量を行う事により、粒子数をゲノムTiter(viral genome[vg]/mL)として算出できる。

図3 超遠心チューブの準備と超遠心チューブからの回収
(A) ウイルス溶液を吸上針を用いてチューブにロードする (B) OptiPrep™を底面側から重層する(※界面が分かりやすいように、 OptiPrep™にフェノールレッドで色を付けている。普段は色は付けていないが、それでも十分に界面は確認できる。)(C) 超遠心チューブをシールする (D) 連続グラジエントを作成する (E)超遠心機とロータ (F) Fraction Recovery System(H) 下部に針で穴を空け、ウイルス溶液を回収する。
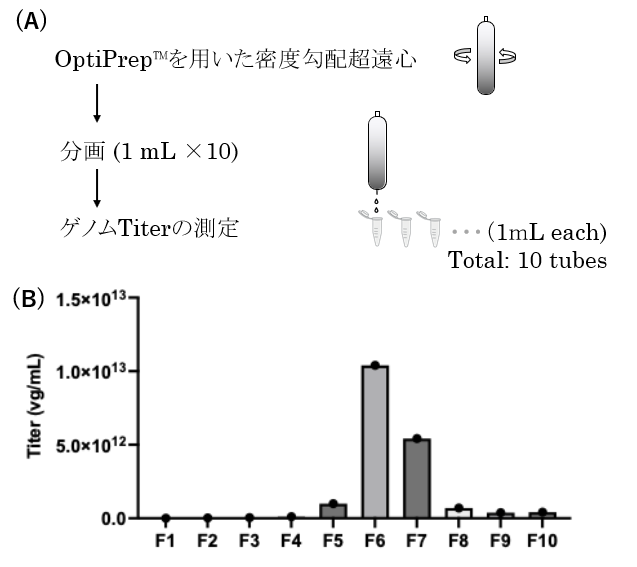
OptiPrep™を用いた密度勾配超遠心後の分画例
上記作製プロトコールでは、著者らが普段実施している「最下部4 mlを廃液として捨てて、その上5 mlをウイルス溶液として回収する(図3H)」の例を示したが、最後にOptiPrep™の分画性能の高さを示すため、1mLずつ回収して、それぞれのゲノムTiterを測定した場合(図4A)の例をお示ししようと思う。各1mLに回収したチューブFraction1(F1)~F10までの測定結果を図4Bに示した。ここに示すとおり、想定通りF1~4まではAAVベクターはほぼ検出されず、F6とF7に鋭いピークとして検出された。ゲノムとして取り込ませる発現ベクターのサイズにも依存するが、これまでの経験上、主にF5~F9の画分にAAVベクターが存在していることを確認しており、今では分画を経ずにF5~F9に該当する部分5 mLを回収している。
さいごに
著者が所属する群馬大学医学系研究科脳神経再生医学分野は、著者自身が中心となって、日本最大級のウイルスベクターコアを運営している。ウイルスベクターコアの活動においては、毎週多数のAAVベクターを再現性よく調製することが重要である。OptiPrep™を用いた密度勾配遠心分離法の再現性の良さが、本ウイルスベクターコアの活動を陰で支えていると言っても過言ではないだろう。
- Konno, A. & Hirai, H. Efficient whole brain transduction by systemic infusion of minimally purified AAV-PHP.eB. J. Neurosci. Methods 346, 108914 (2020).
- Qu, G. et al. Separation of adeno-associated virus type 2 empty particles from genome containing vectors by anion-exchange column chromatography. J. Virol. Methods 140, 183-192 (2007).
- Urabe, M. et al. Removal of empty capsids from type 1 adeno-associated virus vector stocks by anion-exchange chromatography potentiates transgene expression. Mol. Ther. 13, 823-828 (2006)
- Gao, K. et al. Empty virions in AAV8 vector preparations reduce transduction efficiency and may cause total viral particle dose-limiting side-effects. Mol. Ther. Methods Clin. Dev. 1, 20139 (2014).
- Hermens, W. T. et al. Purification of recombinant adeno-associated virus by iodixanol gradient ultracentrifugation allows rapid and reproducible preparation of vector stocks for gene transfer in the nervous system. Hum. Gene Ther. 10, 1885-1891 (1999).
- Strobel, B., Miller, F. D., Rist, W. & Lamla, T. Comparative Analysis of Cesium Chloride- and Iodixanol-Based Purification of Recombinant Adeno-Associated Viral Vectors for Preclinical Applications. Hum. Gene Ther. Methods 26, 147-157 (2015).
- Grieger, J. C., Choi, V. W. & Samulski, R. J. Production and characterization of adeno-associated viral vectors. Nat. Protoc. 1, 1412-1428 (2006).
実験医学別冊
決定版 ウイルスベクターによる遺伝子導入実験ガイド
培養細胞から個体まで、研究を飛躍させる実践テクニックのすべて
平井宏和,日置寛之,小林和人/編
2020年11月02日発行
B5判 285ページ
ISBN 978-4-7581-2247-4
























 このページを印刷する
このページを印刷する