商品詳細「Spirochrome プローブ(SiR-Actin/SiR-Tubulin)」
- 【01】 STED顕微鏡とは何ですか?また原理を教えてください。
- 【02】 なぜSiR actin(またはSiR tubulin)は、 STED顕微鏡に適していますか?
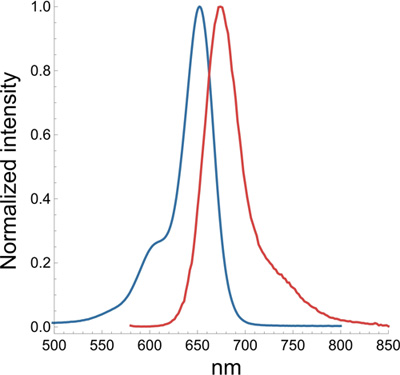
- 【03】 これらのプローブのフィルターセットを教えてください。
- 【04】 なぜSiRプローブは他の蛍光色素分子に比べて低いバックグラウンドを示すのですか?
- 【05】 SiRプローブは、室温で安定ですか?
- 【06】 SiR-actin および SiR-tubulin は細胞毒性を示しますか?
- 【07】 プローブを固定細胞で使用できますか?
- 【08】 STORM でSiRプローブを観察できますか?
- 【09】 SiRプローブで染色できる生物種および組織を教えてください。
- 【10】 3次元培養で、SiR-プローブはワークしますか。
- 【11】 SiR フルオロフォアのCF260およびCF280の補正係数を教えてください。
STED は、誘導放出抑制(Stimulated Emission Depletion microscopy)を意味し、STED顕微鏡とは、光の回折によって制限される従来の光学顕微鏡よりも高い解像度の画像をキャプチャーすることができる超解像顕微鏡の一種です。
STED顕微鏡は、2種類のレーザパルスを使用します。1つは、フルオロフォアを励起して蛍光を生じさせる蛍光パルスです。もう1つのパルスは、STEDパルスと呼ばれ、中央の焦点周囲のフルオロフォアを誘導放出を介して脱励起します。中央の焦点領域は、脱励起されないため、継続して蛍光を発します。これは、円形(いわゆるドーナツ型)にSTEDパルスを集束することにより達成されます。中心の焦点領域は、STEDレーザーパルスを欠いているため、蛍光領域を高解像度で得ることができます。
STED顕微鏡は、ナノメートルスケールで in vivoでの細胞の詳細な研究を可能にします。この超解像顕微鏡を利用するには、蛍光プローブを用いて特異性の高い領域を選択できなければなりません。また、蛍光プローブは、光安定性で、明るく、光毒性の少ない遠赤色スペクトルで励起/発光される必要があります。また、生細胞イメージングにプローブを使用する場合、高い細胞透過性が必要です。SiR actin および SiR tubulin プローブは、これらの要件をすべて満たしています。要するに、 STEDおよびSiRプローブの組み合わせは、細胞内のアクチン、チューブリン/微小管構造の比類のない蛍光可視化と生細胞内でのそれらの物理的特性の評価を可能にします(図2、参考文献2)。
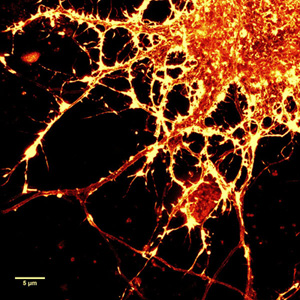

図2.SiR-actinで染色したラット海馬ニューロン培養細胞のSTED 画像
右図:左図の拡大画像。180 nm 間隔で明瞭なアクチンリング(縞模様)を観察できる。
(Courtesy Of Elisa D'Este, MPI Biophysical Chemistry, G?ttingen.)
SiRプローブの励起/蛍光波長が、短波長ではなく、近赤色/遠赤外線赤色スペクトル領域にあるためです。青色光や緑色光などの短波長の使用は、一般的に高いバックグラウンドの原因となる自家蛍光を引き起こします。SiR結合プローブは、下記の2つの物理的状態を持ちます。
1. 非蛍光性、閉環のオフ状態(スピロラクトン:spirolactone)
2. 蛍光性、高度に蛍光を発する開環のオン状態(両性イオン:zwitterion)
標的リガンドと結合したプローブは、高い蛍光性の開環状態で存在する一方、遊離の非結合プローブは、非蛍光性の閉環状態で存在します(図4)。結合状態になると、蛍光が100倍に増幅します。この特性から、結合状態でのみ蛍光を発する高感度なバイオセンサーに応用されます(3、4)。
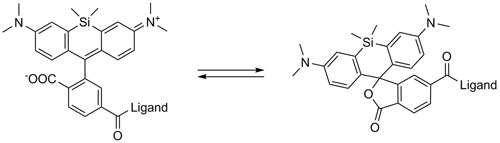
図4. SiR 誘導体は、蛍光性の両性イオン(開環)形と(左)と非蛍光性スピロ(閉環)形(右)との間の平衡状態で存在する。
はい。いずれのプローブでも一定の閾値を超えると、細胞増殖やアクチンまたは微小管動態の変化などに影響します。しかし、プローブは、その親薬物よりも桁違いに低毒性です。HeLa細胞では、100nM 以下の濃度で微小管およびアクチン動態の変化はみられませんでした。この濃度で、SiR プローブは効率的に微小管、F-アクチンを標識し、S/N比の高い画像を捉えます。
SiR-actin プローブは、PFA固定細胞でも使用可能です。SiR-actin は、ファロイジン誘導体と同等の効率でPFA固定細胞中のFアクチンを染色します。SiR-tubulin は、EGS(ethyleneglycol-bis-succinimidyl-succinate)固定細胞でのみ微小管を標識可能です。PFA固定細胞では、中心体微小管の選択的標識が観察されました。SiR-actin および SiR-tubulinは、メタノール固定細胞には適しません。
下記リストに、ワークすることが報告されている生物、細胞株、組織を記載します。記載の無い細胞株、組織、生物で、SIR-プローブがワークしないという意味ではありません。
- ヒト(Homo sapiens): U2OS, fibroblasts, HeLa, HUVEC, MCF-10A, HCT-116, A549, erythrocytes
- マウス(Mus musculus): C2C12, IA32, skeletal muscle, primary cardiomyocyte, primary oocyte
- ラット(Rattus norvegicus): primary hippocampal neurons, primary cortical neurons, NRK
- ミドリザル(Cercopithecus aethiops): COS-7
- ハムスター(Mesocricetus auratus): BHK
- ショウジョウバエ(Drosophila melanogaster): Notum epithelium, S2
- オポッサム(Didelphis marsupialis): OK cells
参考文献
1. Hell S.W. and Wichmann J. 1994. Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy. Opt. Lett. 19, 780-782.
2. D'Este E. et al. 2015. STED nanoscopy reveals the ubiquity of subcortical cytoskeleton periodicity in living neurons. Cell Rep. 10, 1246-1251.
3. Lukinavicius G. et al. 2013. A near-infrared fluorophore for live-cell super-resolution microscopy of cellular proteins. Nat. Chem. 5, 132-139.
4. Lukinavicius G. et al. 2014. Fluorogenic probes for live-cell imaging of the cytoskeleton. Nature Methods. 11, 731-733.