
アクチン染色とは、生細胞および固定細胞における細胞骨格の構造と機能を見るために使用される手法です。 Cytoskeleton(サイトスケルトン/CYT)社では、生細胞および固定細胞のアクチンを染色する商品を各々取り揃えております。 中でもCYT社"Acti-stain™ "シリーズは、蛍光標識したファロイジンで固定細胞を染色し、F-アクチンの分布を蛍光イメージングにより観察することが可能です。
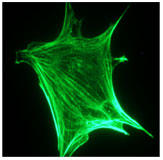
ファロイジン(Phalloidin)とは、タマゴテングタケ(Amanita phalloides)の毒成分として単離された7つのアミノ酸からなるペプチドです。重合アクチン(F-actin)に対し、特異的な高い結合力(Kd値 20nM)を示します。また、アクチン重合の臨界濃度を1μg/ml以下に低下させることでも知られ、重合促進剤としても働きます。さらには、ファロイジン(Phalloidin)を緑色蛍光色素で標識することによって培養細胞や組織切片のアクチンフィラメント染色が可能となります[2]。
蛍光ファロイジン(fluorescent phalloidin)は、その構成によって染色特性が大きく異なります。 例えば、正または負に帯電する蛍光色素は、イオン性の相互作用を介してアクチン以外のタンパク質と非特異的に結合する場合があり、高いバックグラウンドを生む原因になります。Cytoskeleton(サイトスケルトン/CYT)社"Acti-stain™ "シリーズの色素は、非イオン性のためバックグラウンドが低く、染色後の洗浄操作なしで使用することができます。
低バックグラウンドと高輝度化を実現するための課題は、色素とファロイジン(Phalloidin)の近接[4]または色素とアクチン[5]の近接によって起こるクエンチング(消光)の量です。CYT社では、様々な色素とリンカーの組み合わせについてスクリーニングを行い、元の蛍光色素と同等の輝度を維持した最適な組み合わせをみつけることに成功しました。
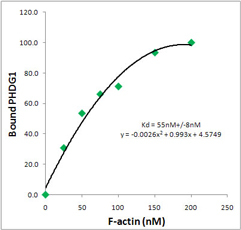
蛍光色素の輝度は、上述のクエンチングの他に環境的な因子によっても制御されます。また、色素の回転性による影響も考慮され、色素が自由に動く状態の場合、エネルギーが熱として消散されるため蛍光が減少します。量子収量により判定される色素の回転性は、より明るい色素の開発を可能にします。 蛍光ファロイジンの輝度は、F-アクチンとの親和性によっても影響を受けます。非標識のファロイジンが約36 nMのKd値を示す一方、標識されたファロイジンは、50 nMから20μMという値の異なるKd値を示します[4]。Kd値が低いほど高い親和性を示し、より明るい染色結果をもたらします。Acti-stain™ 色素は、 50 nMから100 nMのKd値を示し、明るい蛍光シグナルを生成します。
蛍光色素は、顕微鏡の強い光源によって不活性化される場合があります。この現象は、DABCOなどの退色防止剤の使用やイオン化プロトンを除去した色素によって低減することができます。Acti-stain™ を含む最近の多くの色素では、容易にイオン化しないフッ素でイオン化プロトンを置き換えているため、従来のフルオレセインのようには退色しません[6]。以上のように、蛍光ファロイジンのシグナル安定性は、”退色性”と”F-アクチンに対する親和性”という2つの特性に影響されます。F-アクチンに対する親和性による影響は、低親和性のクマリン標識ファロイジン[4]で観察され、顕微鏡観察前の段階で遊離してしまう場合があります。
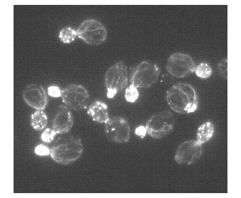
酵母細胞は、異なるアクチンタンパク質を含みますが、Acti-stain™ 488などのいくつかの蛍光ファロイジンとは結合します。
固定細胞におけるアクチン構造は、アクチン抗体[1],蛍光ファロイジン[2],電子顕微鏡[3]によって可視化することができます。
適切に設計された蛍光ファロイジンは、F-アクチンのネイティブな 4 次構造にのみ結合するため、バックグラウンドが低くなります。
ファロイジン結合の固定条件検討を行う場合、タンパク質の四次構造を保持するパラホルムアルデヒドを固定液として使用する必要があります。
メタノールはタンパク質の高次構造を崩壊させるため、ファロイジンによるアクチン染色には適しません。
一方、抗体は単量体と重合体(F-アクチン)の両方を認識するため、F-アクチンのみを染色するプローブと比較してバックグラウンドが高くなる傾向にあります。
ただし、メタノール固定と互換性があるため、メタノール固定を必要とする抗体をと共染色する際に役立ちます。
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Acti-stainTM 488 phalloidin, Plant |
CYT | PHDG1-A | 1*500 UL [300 slides] |
¥79,000 |
Phalloidin; Fluorescent Derivatives (Acti-StainTM 535), Rhodamine Isothiocyanate |
CYT | PHDR1 | 1*500 UL [300 slides] |
¥79,000 |
Acti-stainTM 555 phalloidin, Mushroom |
CYT | PHDH1-A | 1*500 UL [300 slides] |
¥79,000 |
Acti-stainTM 670 phalloidin, Plant |
CYT | PHDN1-A | 1*500 UL [300 slides] |
¥79,000 |
F-Actin Visualization Biochem Kit |
CYT | BK005 | 1 KIT [300 slides] |
¥141,000 |
固定細胞用の商品 "Acti-stain™ "シリーズはこちらから。

サイトスケルトン社では、シグナル伝達や細胞骨格研究および薬剤スクリーニングのための試薬やキットを幅広くご用意しています。 微小管、チューブリン、モータータンパク質、低分子Gプロテインエフェクター、GAP、GEPなどの、各製品やサービスに関連した情報をCYTOSKELETON NEWSでご紹介していますので、ぜひご参照ください。
| サイトスケルトン社 アクチン研究試薬ちらし |
|---|
|
|
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について
© COSMO BIO