近年の研究により、機能ゲノム学のルネッサンスともいえる数々の生物のゲノム配列が明らかになりつつあり、最近では特にヒトゲノムの全長配列といった豊富なDNA配列情報を利用し、ゲノムにコードされた遺伝子について、本来の役割を明らかにする研究がすすめられています。さらに、生化学的ネットワークや情報伝達経路がより理解され、疾患治療の改善へと繋がることが期待されています。
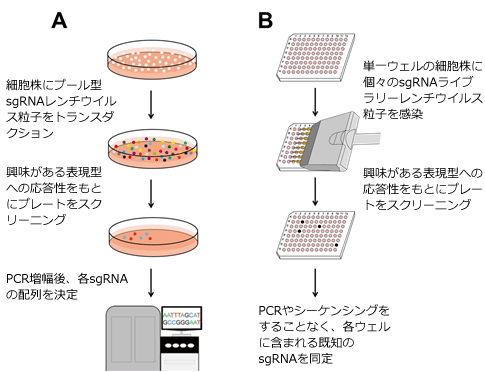
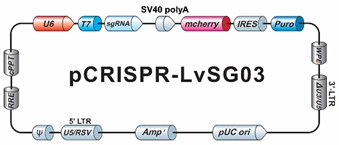
機能ゲノム学の主なアプローチとして、遺伝子を「ノックダウン(低減)」または「ノックアウト(完全除去)」して遺伝子機能を切断する方法がありますが、2012年以降、数々の研究者が機能ゲノム研究にCRISPR-Cas9技術を利用しはじめています。CRISPR-Cas9は、シンプルなRNA誘導型のメカニズムであるため、遺伝子ノックアウト、インフレーム融合タグ付け、変異誘発性、およびトランス遺伝子ノックインといった多くのアプリケーションに対して迅速、簡便かつ比較的低価格で利用することが可能です。近年、いくつかのグループが大規模なCRISPR-Cas9 sgRNAライブラリーを開発し、CRISPR-Cas9技術をハイスループット ノックアウト アプリケーションに利用しています。
GeneCopoeia(GCP)社やApplied Biological Materials(APB)社では、より小規模で伝達経路や遺伝子群に焦点をあてたCRISPR-Cas9 sgRNAライブラリーやご自身で選択した遺伝子に対するカスタムメイドのsgRNAライブラリーを数々発売しています。これらは、全ゲノムを対象としたライブラリーに比べて、いくつかの利点があります。本稿では、CRISPR-Cas9 sgRNAライブラリーの特長、アプリケーションや使用方法、小規模で伝達経路や遺伝子群に焦点をあてたCRISPR-Cas9 sgRNAライブラリーの利点といったことに関して討議します。
Cosmo Bio would like to acknowledge and thank the GeneCopoeia, Inc. for providing the information of CRISPR-Cas9 technology for the genome-wide screening presented here.
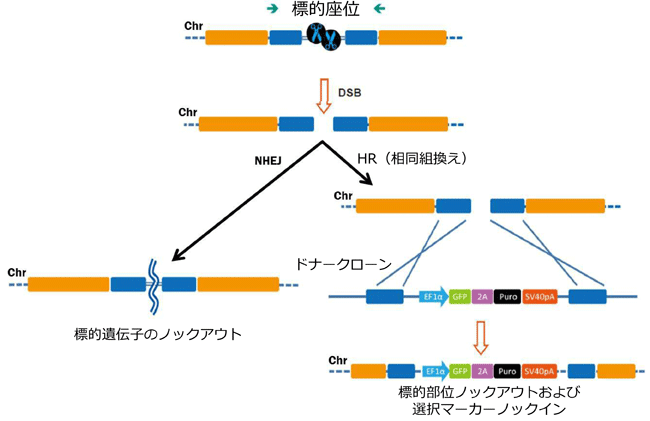
図.1 CRISPR-Cas9により誘導されたDSB(DNA二本鎖切断)の修復経路
左:NHEJ(非相同性末端結合) 右:ドナーコンストラクト存在下におけるHR(相同組換え)