ゲノム編集はゲノムDNAの標的領域に特異的な変化/変異をもたらす強力なアプローチです(Bogdanove & Voytas, 2011; van der Oost, et al., 2013の総説を参照)。近年、植物の病変形成や適応免疫といった細菌のシステムを利用するTALENおよびCRISPR-Cas9の2種類のゲノム編集技術が登場しました。TALENとCRISPR-Cas9の何れの技術も、実質的にゲノム上の如何なる標的配列に対しても二本鎖切断(DSBs)を生ずることのできるキメラのエンドヌクレアーゼを利用して変異誘発を行います。ゲノム編集には、遺伝子ノックアウト、遺伝子タグ付けおよび遺伝的欠陥矯正といった数々のアプリケーションがあります。さらに、ゲノム編集手法ではRosa26やAAVS1セーフ・ハーバー座位をはじめとする如何なる座位にもトランス遺伝子を挿入することができます。TALEN-あるいはCRISPR-Cas9誘導性の二本鎖切断(DSBs)は、ドナーDNA鋳型存在下において相同組換えにより修復されます(図.1)。二本鎖切断(DSBs)の隣接領域と相同配列をもつ組換え「アーム」間に希望する配列を含めることで、トランス遺伝子の「ノックイン」が可能となります。
関連技術情報
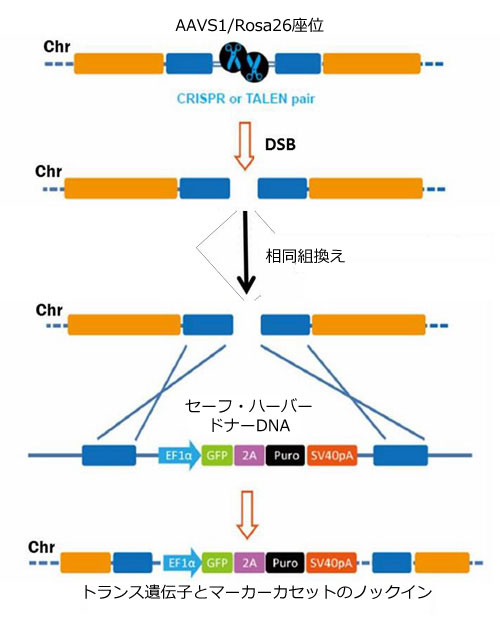
図.1 相同組換えによるセーフ・ハーバーノックイン手法の一般的概要図
GeneCopoeia(GCP)社では、CRISPR-Cas9によるセーフ・ハーバーノックイン用のゲノム編集用ツールおよび20,000種以上におよぶORFクローンをご提供しています。以下に、これらのセーフ・ハーバーツールの効率を培養細胞アッセイにより実験的に検証した結果を示します。
Rosa26用には、特定座位に二本鎖切断(DSBs)を産生する3種類のTALENヌクレアーゼと1種類のCRISPR-Cas9ヌクレアーゼを設計しました。次に、マウスNeuro2a細胞にそれぞれのヌクレアーゼと赤色蛍光タンパク質(RFP)とカイアシ類緑色蛍光タンパク質(copGFP)の両方をもつ相同性ドナーコンストラクトをトランスフェクションしました。コントロールは、ドナーコンストラクトのみをトランスフェクションしたものを使用しました。トランス遺伝子はピューロマイシン耐性マーカーをもっているため、トランスフェクションした細胞をピューロマイシン処理することでトランス遺伝子がゲノムに挿入されたクローンを選択することができます。組込みが生じた場合、ピューロマイシン耐性細胞は蛍光顕微鏡観察で緑色かつ赤色として確認することができます。トランス遺伝子組込みはランダムに、あるいはRosa26部位を介して生ずるため、目的接合部位を挟んだ位置に設計されたプライマーを用いてPCRを行い、標的した相同組換えのスクリーニングを行います。トランスフェクションの結果は図.2に示しました。蛍光分析により、ドナープラスミドのみをもつ細胞に比べ、TALENとCRISPR-Cas9の何れにおいても、トランス遺伝子挿入頻度が高レベルに組込みが誘導されることが示唆されました。さらに、回収した細胞からゲノムDNAを抽出し、Rosa26部位を含んだトランス遺伝子接合部位にまたがる位置に設計したプライマーを用いてPCRを行った結果、TALENあるいはCRISPR-Cas9によりトランスフェクションされた細胞のみが本アッセイにおいて陽性を示すことを確認しています(図.2、右)。本検証結果より、GeneCopoeia(GCP)社のセーフ・ハーバーノックイン用のゲノム編集用ツールはマウスのセーフ・ハーバー座位における高レベルでの組換えが可能であることが明らかとなりました。
*ただし、GeneCopoeia(GCP)社ではトランス遺伝子のランダム組込みが生じた細胞に関しては分析を行っていません。
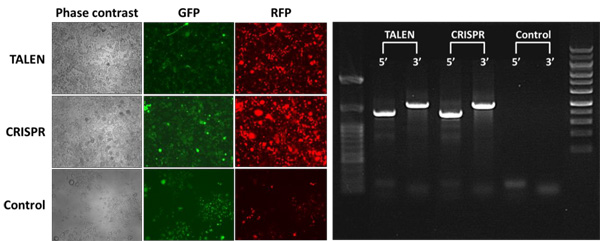
図.2 Rosa26部位におけるTALENおよびCRISPR-Cas9介在型トランス遺伝子組込み
左図:Neuro2a細胞にTALENまたはCRISPR-Cas9とドナープラスミドを同時導入、またはドナープラスミドのみを導入(コントロール)。ピューロマイシン処理を12日行った後、緑色および赤色蛍光を評価した。
右図:TALEN, CRISPR-Cas9またはコントロール細胞における接合部PCR結果。
GeneCopoeia(GCP)社では、第19染色体上のヒトAAVS1座位における部位特異的トランス遺伝子組込みツールもご提供しています。Rosa26実験と同様のアッセイにおいて、HEK293T細胞にAAVS1 TALENとSOX2またはOCT4といったトランス遺伝子をもつドナープラスミドをトランスフェクションしました。トランス遺伝子はピューロマイシン耐性遺伝子と蛍光マーカーとしてGFPも持ちます。14日間のピューロマイシン選択後、GFP発現細胞を容易に同定することができました(図.3)。ここでも、これらの細胞へのランダムなトランス遺伝子組込みを除外することはしていませんが、5'と3'境界を挟んだプライマーを用いたPCR分析ではTALENとドナーコンストラクトをトランスフェクションした細胞からは、AAVS1部位へのトランス遺伝子組込みが確認できています(データ未提示)。
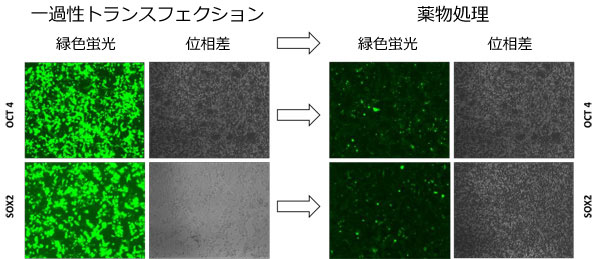
図.3 ヒトAAVS1セーフ・ハーバー用GeneCopoeia 社TALENにより2種類の導入遺伝子に対する部位特異的組込みが促進した。
GFPと位相差画像は何れも1μg/ml ピューロマイシン処理前(左図:一過性トランスフェクション)と14日間にわたる処理後(右図:薬物処理)を示す。
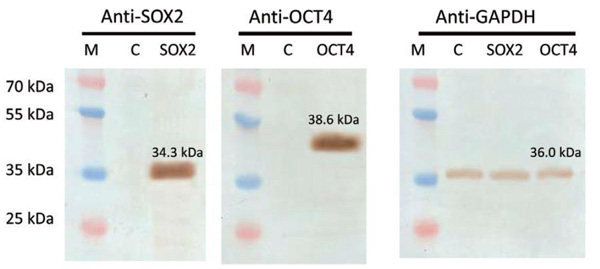
図.4 SOX2とOCT4 ORF導入遺伝子がヒトAAVS1セーフ・ハーバー部位に組込まれた細胞を用いたウェスタンブロット解析結果。メンブレンフィルターはタンパク質特異的抗体を用いてプローブした。
M: マーカー
C: トランスフェクションを行っていない細胞 Anti-GAPDHを添加コントロールとして使用した。本解析における内在性Sox2とOct4タンパク質レベルは検出限度未満であった。
ヒトおよびマウス用セーフ・ハーバーノックインゲノム編集ツールの使い勝手をより良くするために、GeneCopoeia(GCP)社では、ヒトAAVS1部位用セーフ・ハーバーノックインORFクローンをご提供しています。GeneCopoeia(GCP)社は、従来トランスクリプトーム全体にわたる発現実験にすぐに利用できる、哺乳類ORFクローンの製造メーカーですが、ヒト セーフ・ハーバー技術用に、AAVS1部位にノックイン可能なドナークローンとして最適化した、18,000種以上ものヒトORFドナークローンを再構築しました(図.5)。
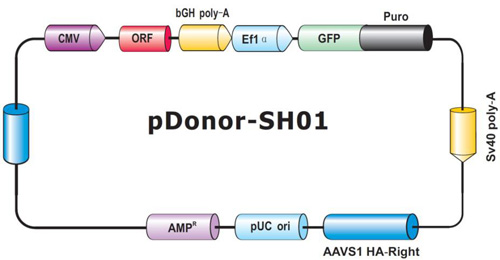
図.5 ヒトAAVS1セーフ・ハーバーノックインORFクローン用GeneCopoeia社ドナーベクター。
"ORF"モジュール(赤色)はセーフ・ハーバーノックイン用に18,000種以上ご用意しているヒトORF配列を示す。
































